题目内容
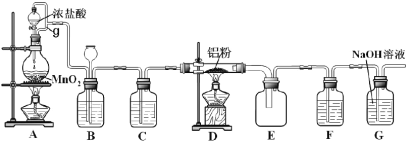
【题目】研究性学习的本质在于,让学生亲历知识产生与形成的过程。我校某化学研究性学习小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3灼烧制成Na2CO3.
【实验设计】如图1所示

【实验探究】
(1)装置乙的作用是 .
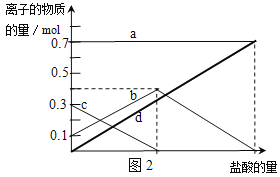
(2)若在NaHCO3灼烧中时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 。
(3)若将装置甲产生的纯净的CO21.68L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为7.4g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
【答案】(1)除去CO2中的HCl (2)HCO3﹣; 3﹕1;(3)Na2CO3和NaHCO3; 1.25 mol/L
【解析】
试题(1)在装置甲中发生反应制取CO2气体,由于盐酸有挥发性,所以在CO2气体中含有杂质HCl,装置乙的作用是除去二氧化碳中的氯化氢气体。
(2)向含有Na2CO3、NaHCO3的混合物中加入盐酸,会发生反应:Na2CO3+ HCl=NaCl+ NaHCO3 ,所以n(CO32-)会逐渐减少,当该反应恰好完全时,n(CO32-)=0,用c表示;n(HCO3-)首先会逐渐增多,当该反应恰好完全时,n(HCO3-)达到最大值,后会发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑n(HCO3-)由消耗而逐渐减少,最后为0 ,用b表示;而n(Na+)的物质的量始终保持不变,用a表示;n(Cl-)则会随着盐酸的加入而逐渐增多,因此用d表示;则曲线b对应的溶液中的离子是HCO3-。根据图示可知n(Na2CO3)=0.3mol,n(NaHCO3)=0.4mol—0.3mol =0.1mol,该样品中NaHCO3和Na2CO3的物质的量之比是3:1;
(3)n(CO2)=1.68L÷22.4L/mol=0.075mol,将其通入100mLNaOH溶液中,若完全转化为Na2CO3,根据C守恒可得质量是0.075mol×106g/mol=7.95g,若完全转化为NaHCO3,其质量是0.075mol×84g/mol=6.3g,现在得到的固体质量是7.95g>7.4g>6.3g,说明是Na2CO3、NaHCO3 的混合物,假设在混合物中Na2CO3、NaHCO3 的物质的量分别是x、y,则根据C守恒可得x+y=0.075;根据质量守恒可得106x+84y=7.4,解得x=0.05mol,y=0.025mol,所以根据Na元素守恒可得n(NaOH)=2n(Na2CO3)+ n(NaHCO3)=2×0.05mol+0.025mol=0.125mol,所以c(NaOH)=0.125mol÷0.1L=1.25mol/L。

【题目】结构决定性质,有机化合物的结构也是研究有机物性质的基础。
(1)烷基是烷烃失去一个或若干氢原子后剩下的电中性的原子团,请在方框内写出甲基的电子式_______。

(2)有一类有机物,它的一卤代物只有一种,如![]() 、
、![]() 等。请写出另外两种满足该条件烷烃的结构简式,并用系统命名法命名。
等。请写出另外两种满足该条件烷烃的结构简式,并用系统命名法命名。
结构简式 | _______ | _______ |
系统命名 | _______ | _______ |
(3)烷烃都是由共价键形成的有机物,若用I表示一个烷烃分子中的共价键数,n表示该烷烃的碳原子数,则丙烷(![]() )的共价键数
)的共价键数![]() ____________﹔若某烷烃的共价键数
____________﹔若某烷烃的共价键数![]() ,则
,则![]() ____________。
____________。
(4)烃的结构主要由碳原子的连接顺序决定,因此我们常通过键线式来表示烃的结构,其中每个端点和拐角都代表一个碳,每个碳原子连接的氢原子都不表示出来。A、B、C分别表示三种物质的空间立体结构:
A. 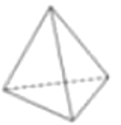 B.
B.  C.
C. 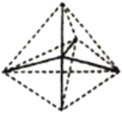
①上述结构中的C不可能是烃,理由是______________________________。
②B分子的分子式是__________________,其一氯代物共有____________种。
③在结构A的每两个碳原子之间插入一个![]() 原子团,可以形成金刚烷的结构,写出金刚烷的分子式__________________。
原子团,可以形成金刚烷的结构,写出金刚烷的分子式__________________。