题目内容
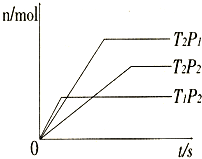 (2010?临沂一模)反应2A(g)+B(g)?2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如图所示,下列判断正确的是( )
(2010?临沂一模)反应2A(g)+B(g)?2C(g);△H=akJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y)与反应时间(t)的关系如图所示,下列判断正确的是( )分析:根据温度、压强对平衡移动的影响分析,温度越高、压强越大,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大.
解答:解:根据温度对反应速率的影响可知,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:T1>T2;
根据压强对反应速率的影响可知,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P1>
P2;
A、升高温度时,平衡向吸热方向移动,当a大于0时,反应向正反应方向移动,导致Y的物质的量减少,所以Y可能是A或B,故A正确.
B、升高温度时,平衡向吸热方向移动,当a小于0时,反应向逆反应方向移动,Y的物质的量减少,所以Y是C,故B错误.
C、升高温度时,平衡向吸热方向移动,当a大于0时,反应向正反应方向移动,导致Y的物质的量减少,所以Y可能是A或B,故C错误.
D、升高温度时,平衡向吸热方向移动,当a小于0时,反应向逆反应方向移动,Y的物质的量减少,所以Y是C,故D正确.
故选AD.
根据压强对反应速率的影响可知,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P1>
P2;
A、升高温度时,平衡向吸热方向移动,当a大于0时,反应向正反应方向移动,导致Y的物质的量减少,所以Y可能是A或B,故A正确.
B、升高温度时,平衡向吸热方向移动,当a小于0时,反应向逆反应方向移动,Y的物质的量减少,所以Y是C,故B错误.
C、升高温度时,平衡向吸热方向移动,当a大于0时,反应向正反应方向移动,导致Y的物质的量减少,所以Y可能是A或B,故C错误.
D、升高温度时,平衡向吸热方向移动,当a小于0时,反应向逆反应方向移动,Y的物质的量减少,所以Y是C,故D正确.
故选AD.
点评:本题考查化学平衡图象题,题目难度中等,明确温度、压强对化学平衡的影响是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
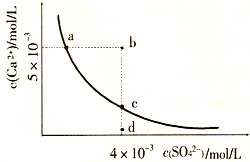 (2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
(2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
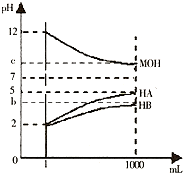 (2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: