题目内容
 氢气燃烧生成液态水的热化学方程式是
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol. 请回答下列问题:
(1)生成物能量总和
<
<
(填“>”、“<”或“=”)反应物能量总和.(2)若1mol氢气完全燃烧生成水蒸气,则放出的热量
<
<
(填“>”、“<”或“=”)286kJ.(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造的一部分如右图所示:a、b两个电极均由多孔的碳块组成.此装置的负极反应式为
H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
,当正极消耗5.6L(标准状况)气体时,外电路转移的电子数为6.02×1023
6.02×1023
.分析:(1)根据放热反应中生成物能量总和与反应物能量总和的关系;
(2)根据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol进行计算以及液态水变成水蒸气需要吸热来判断;
(3)根据燃料电池中负极失去电子,化合价升高,正极得到电子,化合价降低以及正极的电极反应式求出外电路转移的电子数.
(2)根据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol进行计算以及液态水变成水蒸气需要吸热来判断;
(3)根据燃料电池中负极失去电子,化合价升高,正极得到电子,化合价降低以及正极的电极反应式求出外电路转移的电子数.
解答:解:(1)因放热反应中生成物能量总<与反应物能量总和,而2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol是放热反应,故答案为:<;
(2)据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol,2mol氢气完全燃烧生成液态水放出热量
572kJ,反应热随反应物的物质的量增大或减小相同的倍数,故1mol氢气完全燃烧生成液态水放出热量
286kJ,因液态水变成水蒸气需要吸热,所以1mol氢气完全燃烧生成水蒸气放出热量小于286kJ,故答案为:<;
(3)因燃料电池的总反应为:2H2+O2=2H2O,通入负极的是H2,电极反应式:H2-2e-+2OH-=2H2O,通入正极的是O2,
设转移的电子为Xmol,电极反应式:
O2 +4e-+2H2O=4OH-
22.4L/mol 4mol
5.6L Xmol
=
解得:x=1mol
故转移电子物质的量为6.02×1023
故答案为:H2-2e-+2OH-=2H2O;6.02×1023 .
(2)据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol,2mol氢气完全燃烧生成液态水放出热量
572kJ,反应热随反应物的物质的量增大或减小相同的倍数,故1mol氢气完全燃烧生成液态水放出热量
286kJ,因液态水变成水蒸气需要吸热,所以1mol氢气完全燃烧生成水蒸气放出热量小于286kJ,故答案为:<;
(3)因燃料电池的总反应为:2H2+O2=2H2O,通入负极的是H2,电极反应式:H2-2e-+2OH-=2H2O,通入正极的是O2,
设转移的电子为Xmol,电极反应式:
O2 +4e-+2H2O=4OH-
22.4L/mol 4mol
5.6L Xmol
| 22.4L/mol |
| 5.L |
| 4mol |
| xmol |
解得:x=1mol
故转移电子物质的量为6.02×1023
故答案为:H2-2e-+2OH-=2H2O;6.02×1023 .
点评:本题考查学生燃料电池的相关知识,难度不大,平时注意知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol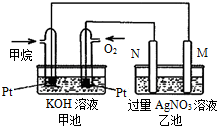 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.