ЬтФПФкШн
ЁОЬтФПЁПClO2 ЪЧвЛжжИпаЇАВШЋЕФЩБОњЯћЖОМСЁЃгУТШЛЏФЦЕчНтЗЈЩњГЩClO2ЕФЙЄведРэЪОвтЭМШчЯТЭМ, ЗЂЩњЦїФкЕчНтЩњГЩClO2ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
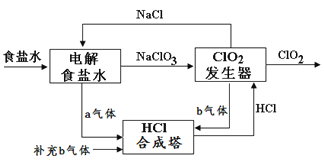
A. aЦјЬхЪЧТШЦјЃЌbЦјЬхЪЧЧтЦј
B. ТШЛЏФЦЕчНтВлФкУПЩњГЩ2 mol aЦјЬхЃЌзЊвЦ2mol e-
C. ClO2ЗЂЩњЦїжавѕМЋЕФЕчМЋЗДгІЪНЮЊЃК2ClO3- + 12H+ + 10e-![]() Cl2Ёќ + 6H2O
Cl2Ёќ + 6H2O
D. ЮЊЪЙaЁЂbЦјЬхЧЁКУЭъШЋЗДгІЃЌРэТлЩЯУПЩњВњ1molClO2ашвЊВЙГф56L(БъзМзДПі)bЦјЬх
ЁОД№АИЁПD
ЁОНтЮіЁПИљОнСїГЬЭМПЩжЊМгШыЮяжЪЮЊNaClO3КЭHClЃЌЩњГЩClO2ЃЛЗЂЩњбѕЛЏЛЙдЗДгІЃЌNaClO3БЛЛЙдЩњГЩClO2ЃЌHClБЛбѕЛЏЩњГЩCl2ЃЌЭЌЪБЩњГЩЫЎЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ2NaClO3+4HCl=2ClO2Ёќ+Cl2Ёќ+2NaCl+2H2OЃЌЙЪЦјЬхbЪЧТШЦјЃЌЦјЬхaЪЧЧтЦјЃЌЙЪAДэЮѓЃЛТШЛЏФЦЕчНтВлФкУПЩњГЩ2 mol ЧтЦјЃЌзЊвЦ4mol e-ЃЌЙЪBДэЮѓЃЛClO2ЗЂЩњЦїжавѕМЋЕФЕчМЋЗДгІЪНЮЊЃКClO3- + 2H+ + e-![]() ClO2Ёќ + H2OЃЌЙЪCДэЮѓЃЛИљОн2NaClO3+4HCl=2ClO2Ёќ+Cl2Ёќ+2NaCl+2H2OУПЩњВњ1molClO2ЃЌашвЊ1mol NaClO3ЃЌЭЌЪБЩњГЩ0.5 molТШЦјЃЌИљОнЕчзгЪиКуТШЛЏФЦЕчНтВлФкУПЩњГЩ1mol NaClO3ЃЌЭЌЪБЩњГЩ3 molЧтЦјЃЌЮЊЪЙaЁЂbЦјЬхЧЁКУЭъШЋЗДгІЃЌРэТлЩЯУПЩњВњ1molClO2ашвЊВЙГфТШЦј2.5 molЃЌЙЪDе§ШЗЁЃ
ClO2Ёќ + H2OЃЌЙЪCДэЮѓЃЛИљОн2NaClO3+4HCl=2ClO2Ёќ+Cl2Ёќ+2NaCl+2H2OУПЩњВњ1molClO2ЃЌашвЊ1mol NaClO3ЃЌЭЌЪБЩњГЩ0.5 molТШЦјЃЌИљОнЕчзгЪиКуТШЛЏФЦЕчНтВлФкУПЩњГЩ1mol NaClO3ЃЌЭЌЪБЩњГЩ3 molЧтЦјЃЌЮЊЪЙaЁЂbЦјЬхЧЁКУЭъШЋЗДгІЃЌРэТлЩЯУПЩњВњ1molClO2ашвЊВЙГфТШЦј2.5 molЃЌЙЪDе§ШЗЁЃ

ЁОЬтФПЁПРћгУЫЎюмПѓ[жївЊГЩЗжЮЊCo2O3КЭCo(OH)3ЃЌЛЙКЌЩйСПFe2O3ЁЂAl2O3ЁЂMnOЕШ]жЦШЁCoCl2ЁЄ6H2OЕФЙЄвеСїГЬШчЯТЃК

вбжЊЃКЂйНўГівККЌгаЕФбєРызгжївЊгаH+ЁЂCo2+ЁЂFe2+ЁЂMn2+ЁЂAl3+ЕШЃЛ
ЂкВПЗжбєРызгвдЧтбѕЛЏЮяаЮЪНГСЕэЪБШмвКЕФpHМћЯТБэЃК
ГСЕэЮя | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
ПЊЪМГСЕэ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
ЭъШЋГСЕэ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
ЃЈ1ЃЉЬсИпЫЎюмПѓНўГіЫйТЪЕФДыЪЉга_______________________________________ЃЈЬюаДСНЕуЃЉЃЌНўГіЙ§ГЬжаCo2O3ЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ________________________ЁЃ
ЃЈ2ЃЉNaClO3ЕФзїгУЪЧ_________________________________ЁЃ
ЃЈ3ЃЉМгNa2CO3ЕїpHжС5.2ЫљЕУГСЕэЮЊ_________________ЁЃ
ЃЈ4ЃЉнЭШЁМСЖдН№ЪєРызгЕФнЭШЁТЪгыpHЕФЙиЯЕШчЭМЁЃнЭШЁМСЕФзїгУЪЧ___________________________________________ЃЛЦфЪЙгУЕФЪЪвЫpHЗЖЮЇЪЧ______________ЁЃ
AЃЎ2.0~2.5 BЃЎ3.0~3.5 CЃЎ4.0~4.5

ЃЈ5ЃЉгЩнЭШЁКѓгрвКЛёЕУДжВњЦЗЕФВйзїВНжшЮЊ_____________ЁЃ