题目内容
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
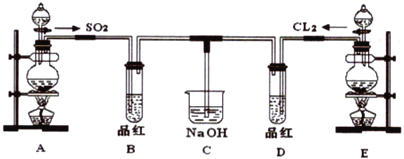
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________。
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①指出该反应中在反应中HCl(浓)所表现出的化学性质_____________、___________。
②请把(2)中的化学方程式改写为离子方程式_______________________________________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项,下同。
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为__________。
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是________________________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________________________。
【答案】 分液漏斗的塞子没有取下来或者装置内外压强不相等 酸性 还原性 MnO2+2Cl-+4H+ ==△=Mn2++2H2O+Cl2↑ A D 吸收过量的SO2和Cl2,防止污染环境 Cl2+SO2+2H2O==2HCl+H2SO4
【解析】(1) 打开A的分液漏斗活塞后,漏斗中液体未流下,可能的原因是分液漏斗上方的塞子没有取下来,或者装置内的压强大于装置外的压强;
(2) ①已知化学反应MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O中Cl元素从-1价升高为0价,所以盐酸作还原剂,又有MnCl2 生成,盐酸起酸性作用;②该反应中只有HCl 和MnCl2 是可溶性强电解质,可拆为离子形式,所以反应的离子方程式为MnO2+2Cl-+4H+
MnCl2 +Cl2↑+2H2O中Cl元素从-1价升高为0价,所以盐酸作还原剂,又有MnCl2 生成,盐酸起酸性作用;②该反应中只有HCl 和MnCl2 是可溶性强电解质,可拆为离子形式,所以反应的离子方程式为MnO2+2Cl-+4H+ ![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
(3) ①由于SO2具有漂白性,能使品红溶液褪色,而氯气溶于水生成的HClO也具有漂白性,也能使品红溶液褪色,所以正确答案选A;②停止通气后,给B、D两试管加热,由于SO2是与品红等反应生成无色不稳定的物质而褪色的,所以加热后又恢复红色,而HClO具有强氧化性,把有色物质氧化而褪色的,所以加热不会恢复红色,故正确答案选D;
(4) SO2和Cl2都是有毒的气体,又都能与碱反应,所以可用NaOH吸收多余的气体,防止污染环境;
(5)由于Cl2具有强氧化性,而SO2具有还原性,所以二者混合后发生反应Cl2+SO2+2H2O == 2HCl+H2SO4生成了盐酸和硫酸,而这两种酸都没有漂白性,所以品红溶液不褪色。

 名师点睛字词句段篇系列答案
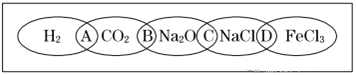
名师点睛字词句段篇系列答案【题目】下列图中的实验方案,能达到实验目的的是( )
实验方案 | 实验目的 | |
A |
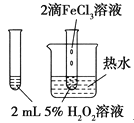
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
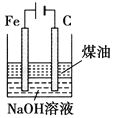
| 制备Fe(OH)2并能较长时间观察其颜色 |
C |
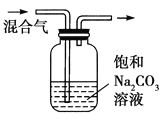
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D