题目内容
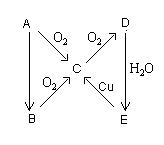
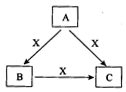
(8分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
(1)写出A的电子式_____________。
(2)将X通入水玻璃溶液中,写出反应的离子方程式___________。
(3)自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
(4)写出区分B、C溶液的一种实验方案

(1)写出A的电子式_____________。
(2)将X通入水玻璃溶液中,写出反应的离子方程式___________。
(3)自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
(4)写出区分B、C溶液的一种实验方案
(1)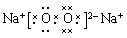 (2分)
(2分)
(2)2H2O+2CO2+SiO32--=H2SiO3↓+2HCO3-;或H2O+CO2+SiO32--=H2SiO3↓+CO32-(2分)
(3)2.65 g (2分)
(4)合理即可 (2分)
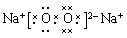 (2分)
(2分)(2)2H2O+2CO2+SiO32--=H2SiO3↓+2HCO3-;或H2O+CO2+SiO32--=H2SiO3↓+CO32-(2分)
(3)2.65 g (2分)
(4)合理即可 (2分)
根据物质的性质可知,A是氢氧化钠,B是碳酸钠,C是碳酸氢钠,X是CO2。
(1)氢氧化钠中还原离子键和极性键,电子式为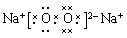 。
。
(2)碳酸的酸性强于硅酸的,所以方程式为2H2O+2CO2+SiO32--=H2SiO3↓+2HCO3-;或H2O+CO2+SiO32--=H2SiO3↓+CO32-。
(3)碳酸氢钠加热分解生成碳酸钠,根据钠原子守恒可知,最终碳酸钠的质量是0.1L×0.5mol/L÷2×106g/mol=2.65g。
(3)碳酸钠能和氯化钙反应生成碳酸钙沉淀,而碳酸氢钠不能,据此可以鉴别。
(1)氢氧化钠中还原离子键和极性键,电子式为
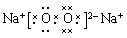 。
。(2)碳酸的酸性强于硅酸的,所以方程式为2H2O+2CO2+SiO32--=H2SiO3↓+2HCO3-;或H2O+CO2+SiO32--=H2SiO3↓+CO32-。
(3)碳酸氢钠加热分解生成碳酸钠,根据钠原子守恒可知,最终碳酸钠的质量是0.1L×0.5mol/L÷2×106g/mol=2.65g。
(3)碳酸钠能和氯化钙反应生成碳酸钙沉淀,而碳酸氢钠不能,据此可以鉴别。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目