题目内容
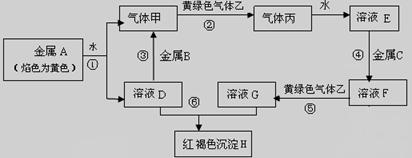
(17分)下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
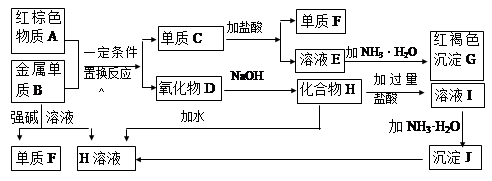
(1)单质B的化学式是 ,单质F的化学式是________ ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式 ,写出由沉淀J生成 H溶液的离子方程式 ,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式 ,白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
(4)溶液I中所含金属离子是_____________________。
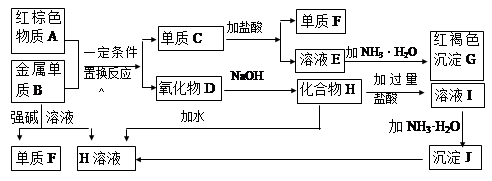
(1)单质B的化学式是 ,单质F的化学式是________ ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式 ,写出由沉淀J生成 H溶液的离子方程式 ,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式 ,白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
(4)溶液I中所含金属离子是_____________________。
17分)(1)Al H2 红色涂料油漆颜料,炼铁等
(2)2Al+2H2O+2OH—=2AlO2—+3H2↑ Al(OH)3+OH—=AlO2-+2H2O
(3)Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+ 灰绿 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4) Al3+和Na+
(2)2Al+2H2O+2OH—=2AlO2—+3H2↑ Al(OH)3+OH—=AlO2-+2H2O
(3)Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+ 灰绿 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4) Al3+和Na+
本题是无机框图题,关键是找准突破点。红褐色沉淀G是氢氧化铁,这说明红棕色物质A应该是氧化铁,和单质铝发生铝热反应,生成氧化铝D和单质C铁。铁和盐酸反应生成F氢气和氯化亚铁E。氧化铝是两性化合物,和氢氧化钠反应生成偏铝酸钠H,偏铝酸钠和过量的盐酸反应生成氯化铝I。氯化铝和氨水反应生成氢氧化铝J,氢氧化铝溶于氢氧化钠,又生成偏铝酸钠。单质铝和强碱反应生成氢气F和偏铝酸钠H。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目