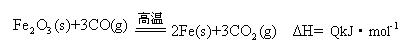题目内容
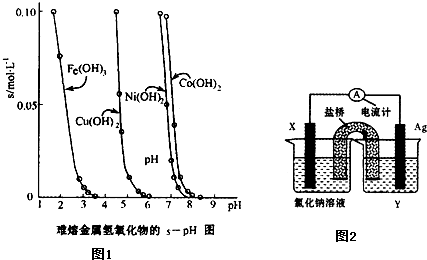
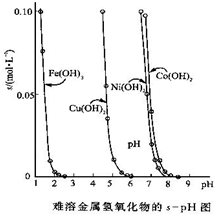 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)如图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)如图.(1)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
②
②
(填序号)①pH<1 ②pH=4左右 ③pH>6
(2)在Ni(NO3)2溶液中含有少量的Co2+杂质,
不能
不能
(填能或不能)通过调节溶液pH的方法来除去.(3)已知一些难溶物的溶度积常数如表.
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
②
②
除去它们.(选填序号)①NaOH ②FeS ③Na2S.
分析:(1)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右;
(2)Co2+和Ni2+沉淀的pH范围相差太小;
(3)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子.
(2)Co2+和Ni2+沉淀的pH范围相差太小;
(3)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子.
解答:解:(1)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右Fe3+沉淀完全,故答案为:②;
(2)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,无法控制溶液的pH,
故答案为:不能;Co2+和Ni2+沉淀的pH范围相差太小;
(3)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子,
故答案为:②.
(2)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,无法控制溶液的pH,
故答案为:不能;Co2+和Ni2+沉淀的pH范围相差太小;
(3)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子,
故答案为:②.
点评:本题考查了沉淀溶解平衡以及溶液PH的分析应用,题目难度中等,解答本题的关键是认真审题,能从图象曲线的变化特点把握物质的溶解性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
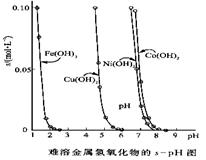
(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S
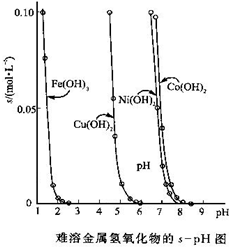 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.