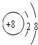题目内容
用化学用语回答下列问题
(1)画出磷原子的原子结构示意图:
 .
.
(2)写出H2S分子的电子式:
 .
.
(3)用电子式表示氯化镁的形成过程:
 .
.
(4)写出氢氧化铝与氢氧化钠溶液的离子反应方程式
(1)画出磷原子的原子结构示意图:


(2)写出H2S分子的电子式:


(3)用电子式表示氯化镁的形成过程:


(4)写出氢氧化铝与氢氧化钠溶液的离子反应方程式
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.分析:(1)P的质子数为15,有3个电子层,最外层电子为5;
(2)H2S为共价化合物,以共用电子对形成化合物;
(3)氯化镁为离子化合物,由离子形成离子键;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
(2)H2S为共价化合物,以共用电子对形成化合物;
(3)氯化镁为离子化合物,由离子形成离子键;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解答:解:(1)P的质子数为15,有3个电子层,最外层电子为5,其原子结构示意图为 ,
,
故答案为: ;
;
(2)H2S为共价化合物,以共用电子对形成化合物,其电子式为 ,
,
故答案为: ;
;
(3)氯化镁为离子化合物,由离子形成离子键,其形成过程为 ,
,
故答案为: ;
;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
 ,
,故答案为:
 ;
;(2)H2S为共价化合物,以共用电子对形成化合物,其电子式为
 ,
,故答案为:
 ;
;(3)氯化镁为离子化合物,由离子形成离子键,其形成过程为
 ,
,故答案为:
 ;
;(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查化学用语,涉及电子式、原子结构示意图、离子反应方程式的书写等,注重基础知识的考查,把握化学用语的规范使用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目