题目内容
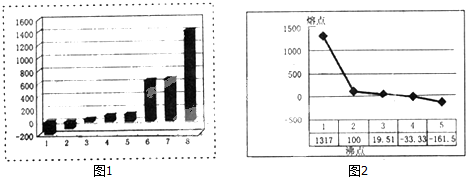
某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Fe的熔点、沸点数据如下:
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金.你认为他的解释是否合理? (填“合理”或“不合理”).
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝.请填写下列表格:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝.请填写下列表格:
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
考点:探究铝热反应
专题:实验设计题,元素及其化合物
分析:(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金;
(2)可以用磁铁检验产物中是否含有铁;
(3)金属铝能和氢氧化钠反应放出氢气,而金属铁和氢氧化钠不反应,据此设计实验方案检验合金中的铝.
(2)可以用磁铁检验产物中是否含有铁;
(3)金属铝能和氢氧化钠反应放出氢气,而金属铁和氢氧化钠不反应,据此设计实验方案检验合金中的铝.
解答:
解:(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,所以铝热反应所得到的熔融物应是铁铝合金,
故答案为:合理;
(2)验证产物中有Fe,最简单的方法为:用磁铁,若能吸引则可验证产物中有Fe,
故答案为:用磁铁,若能吸引则可验证产物中有Fe;
(3)金属铝能和氢氧化钠反应放出氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,而金属铁和氢氧化钠不反应,可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝,所以选用的试剂为氢氧化钠溶液,操作方法及现象为:取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝,
故答案为:
.
故答案为:合理;
(2)验证产物中有Fe,最简单的方法为:用磁铁,若能吸引则可验证产物中有Fe,
故答案为:用磁铁,若能吸引则可验证产物中有Fe;
(3)金属铝能和氢氧化钠反应放出氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,而金属铁和氢氧化钠不反应,可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝,所以选用的试剂为氢氧化钠溶液,操作方法及现象为:取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝,
故答案为:
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ |
点评:本题考查铝热反应原理、金属铝的化学性质,题目难度中等,注意掌握铝热反应发生条件,明确铝的化学性质及合金的物理性质,(1)为易错点,注意分析表中数据.

练习册系列答案
相关题目
下列各溶液中NO3-物质的量浓度最大的是( )
| A、20mL 2mol/L Mg(NO3)2 |
| B、100mL 2.5mol/L NaNO3 |
| C、25mL 1.0mol/L Al(NO3)3 |
| D、30mL 2.5mol/L NH4NO3 |
下列有关说法不正确的是( )
| A、互为同系物的有机物其组成元素相同,且结构必须相似 |
| B、分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 |
| C、分子式为C3H6与C6H12的两种有机物一定互为同系物 |
| D、互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数) |
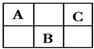 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.