题目内容
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
【答案】 HN3![]() H++N3- c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) 能 正反应方向平衡常数为1031>105 滴入最后一滴标准液,溶液由无色变为红色(紫红色或浅红色也可),且30s不变色
H++N3- c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) 能 正反应方向平衡常数为1031>105 滴入最后一滴标准液,溶液由无色变为红色(紫红色或浅红色也可),且30s不变色 ![]() ×100% AC
×100% AC
【解析】(1)①氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5,说明氢叠氮酸为弱酸,在水溶液中的电离方程式为HN3![]() H++N3-,故答案为:HN3
H++N3-,故答案为:HN3![]() H++N3-;
H++N3-;
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,溶液中存在等物质的量浓度的HN3和Na N3,恢复到25℃,溶液显酸性,以HN3的电离为主,混合溶液中各离子和HN3分子浓度由大到小的顺序为c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-),故答案为:c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-);
③反应为:2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq),该反应的化学平衡常数为K=
Cu2S(s)+2N3-(aq),该反应的化学平衡常数为K=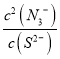 =
=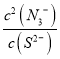
 =
=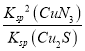 =
=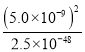 =1.0×1031>105,该反应能够完全进行,故答案为:能;正反应方向平衡常数为1031>105;
=1.0×1031>105,该反应能够完全进行,故答案为:能;正反应方向平衡常数为1031>105;
(2)利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应,Fe2+被氧化成Fe3+,化合价升高1,Mn由+7价→+2,化合价降低5,最小公倍数5,根据原子个数、电荷守恒,配平得MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,向溶液中滴加中高锰酸钾,高锰酸钾显紫红色,因此滴定到终点:滴入最后一滴标准液,溶液由无色变为浅紫色,且30s不变色,因为第一次与第二次、第三次相差较大,忽略不计,消耗高锰酸钾溶液的体积为![]() mL=25mL,根据离子反应方程式,得出:n[(NH4)2SO4FeSO46H2O]=5n(KMnO4) =25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4FeSO46H2O] =25×10-3×c×5×500/25mol =2.5cmol,所以质量分数=2.5c×
mL=25mL,根据离子反应方程式,得出:n[(NH4)2SO4FeSO46H2O]=5n(KMnO4) =25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4FeSO46H2O] =25×10-3×c×5×500/25mol =2.5cmol,所以质量分数=2.5c×![]() ×100%=
×100%=![]() ×100%;A.第一次滴定时,锥形瓶用待装液润洗,锥形瓶中亚铁离子的量偏多,消耗的高锰酸钾偏多,故A正确;B.三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,故B错误;C.滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,故C正确;故选ABC;故答案为:滴入最后一滴标准液,溶液由无色变为浅紫色,且30s不变色;
×100%;A.第一次滴定时,锥形瓶用待装液润洗,锥形瓶中亚铁离子的量偏多,消耗的高锰酸钾偏多,故A正确;B.三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,故B错误;C.滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,故C正确;故选ABC;故答案为:滴入最后一滴标准液,溶液由无色变为浅紫色,且30s不变色; ![]() ×100%;AC。
×100%;AC。

 名校课堂系列答案
名校课堂系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
【题目】Ⅰ、某校兴趣小组的同学进行“比较过氧化氢在不同条件下的分解”的实验,他们对实验的处理如下表所示:
试管 组别 | 实验处理 | ||
加入体积分数为3%的H2O2溶液(mL) | 温度 | 加入试剂 | |
试管1 | 2 | 常温 | 2滴蒸馏水 |
试管2 | a | 90℃ | 2滴蒸馏水 |
试管3 | 2 | 常温 | 2滴质量分数为3.5%的FeCl3溶液 |
试管4 | 2 | b | 2滴质量分数为20%的肝脏研磨液 |
(1)表格中的a、b应填写的内容分别是 和 。在上表的实验处理中,研究了哪些自变量? 。
(2)表中的哪两组试管对照,可研究生物催化剂与无机催化剂催化效率的差别? 。
(3)在探究温度对酶活性的影响时, (填“能”或“不能”)用过氧化氢为实验材料。
Ⅱ、某校兴趣小组的同学进行了“探究酵母菌细胞呼吸的方式”的实验。请据题分析作答:
现提供若干套(每套均有数个)实验装置如图Ⅰ(a~d)所示:

(1)若要探究的具体问题是:酵母菌是否在有氧、无氧条件下均能产生CO2。根据实验目的选择装置序号,有氧条件下的装置序号为c→b→a→b,则无氧条件下的装置序号为: (用字母和箭头表示)。
(2)装置中c瓶的作用是: ,b瓶中澄清的石灰水还可用溴麝香草酚蓝水溶液代替,则颜色变化为: 。
(3)利用图Ⅱ所示装置(橡皮塞上的弯管为带有红色液滴的刻度玻璃管),探究酵母菌的细胞呼吸类型。想得到实验结论还必须同时设置对照实验,对照实验装置(假设该装置编号为Ⅲ)除用等量清水代替NaOH溶液外,其他设计与装置Ⅱ相同。
请预测与结论相符合的现象,并填写下表:
序号 | 装置中红色液滴的移动现象 | 结论 | |
装置Ⅱ | 装置Ⅲ | ||
1 | 向左移 | 不移动 | 只进行有氧呼吸 |
2 | 不移动 | 向右移 |
|
3 | 向左移 |
| 既进行有氧呼吸,又进行无氧呼吸 |


