题目内容
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。

回答下列问题:
(1)题中通入CO2后所得溶液的溶质成分为______________,若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为_____。
(2)原NaOH溶液的物质的量浓度为 _____。
【答案】Na2CO3和NaHCO3 13.7g 2mol/L
【解析】
NaOH溶液吸收CO2气体后,溶液中溶质有多种可能。向所得溶液中滴加盐酸,根据产生CO2的体积与所加盐酸体积之间关系判断溶质成分,进而进行有关计算。
(1)按照CO2由少到多的顺序,NaOH溶液吸收CO2气体后溶质有4种可能:NaOH和Na2CO3、只有Na2CO3、Na2CO3和NaHCO3、只有NaHCO3。逐一分析加入盐酸时产生CO2的体积与盐酸体积的关系,可判断溶质成分。题图前25mL盐酸无气体生成、后75mL盐酸生成CO2气体,则溶质为Na2CO3和NaHCO3。
设溶质Na2CO3和NaHCO3的物质的量分别是x、y,据第一阶段反应Na2CO3+HCl=NaHCO3+NaCl,x=0.025L×2.0mol/L=0.05mol,此时溶液中NaHCO3的物质的量为(x+y)。又据第二阶段反应NaHCO3+HCl=NaCl+CO2↑+H2O,x+y=0.075L×2.0mol/L=0.15mol,则y=0.1mol。低温低压下蒸干所得固体物质为Na2CO3和NaHCO3,其总质量为0.05mol×106g/mol+0.1mol×84g/mol=13.7g。
(2)溶质为Na2CO3和NaHCO3时,NaOH已经完全反应,据Na+数目守恒,n(NaOH)=2x+y=0.2mol,c(NaOH)=0.2mol÷0.1L=2mol/L。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
【题目】铜的电解实现了铜与杂质的分离,也造成了一部分资重金属进入阳极泥中,通过对阳极泥的综合处理可以回收可观的宝贵金属。稀散元素硒和碲广泛用于治金工业、电子工业、国防工业、医学和农业等领域,需求量越来越大。电解精炼铜的阳极泥主要成分为Cu2Se、Cu2Te和少量金属单质Au等,工业上从其中同收碲、硒的一种工艺流程如图:
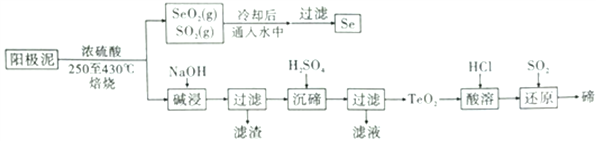
已知:TeO2是两性氧化物,Se和TeO2的物理性质如下表:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)“焙烧”时所加的硫酸浓度最好为_____(填序号)。
a.10% b.50% c.70% d.98%
(2)加硫酸焙烧过程中Cu2Se参与反应的化学方程式为_________,氧化产物和还原产物的物质的量之比是_______。
(3)滤渣的主要成分是_______ (填化学式)。
(4)“酸溶”后,将TeO2先溶于盐酸得到四氯化碲,然后再通入二氧化硫得到碲单质,后者发生反应的化学方程式为______________ 。
(5)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致“沉碲”不完全,原因是______________ 。
(6)过滤所得粗硒中含有Ni、Fe、Cu等杂质,可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是_____(填序号)
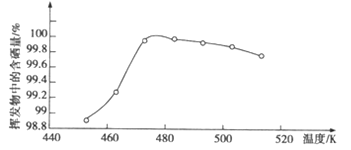
a. 455℃ b.462℃ c.475℃ d.515℃
(7)工业上还可以通过电解铜阳极泥碱浸,过滤后的滤液得到单质碲。己知电解时的电极均为石墨,则阴极的电极反应式为___________。