题目内容
碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,其中H-具有较强的还原性。
(1)常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为_________________________。
(2)NaH能与水剧烈反应生成对应的碱和氢气,反应的化学方程式为_________________ ,并在化学方程式中标明电子转移的方向和数目。该反应中氧化产物和还原产物的质量比为_____________________。
(1)常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为_________________________。
(2)NaH能与水剧烈反应生成对应的碱和氢气,反应的化学方程式为_________________ ,并在化学方程式中标明电子转移的方向和数目。该反应中氧化产物和还原产物的质量比为_____________________。
(1)2NaH+TiCl4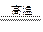 Ti+2NaCl+2HCl↑
Ti+2NaCl+2HCl↑
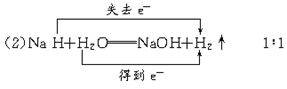
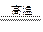 Ti+2NaCl+2HCl↑
Ti+2NaCl+2HCl↑
(1)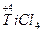

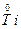 ,Ti元素价态降低,得电子,是氧化剂,NaH和TiCl4反应,谁的价态升高?显然是还原性的H-,Ti已变为单质,Na、H、Cl三元素如何结合?生成NaCl、HCl是必然结果:
,Ti元素价态降低,得电子,是氧化剂,NaH和TiCl4反应,谁的价态升高?显然是还原性的H-,Ti已变为单质,Na、H、Cl三元素如何结合?生成NaCl、HCl是必然结果:
2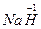 +
+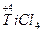 (原子的重新组合)
(原子的重新组合)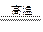 2NaCl+2
2NaCl+2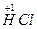 ↑+
↑+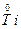 ,用化合价升降总值相等进行验证,十分合理。
,用化合价升降总值相等进行验证,十分合理。
(2)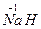 与
与 反应生成
反应生成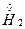 ,发生了氧化还原反应,从价态变化看,应该是+1价H原子得到了-1价H原子的电子。又由于H2O可以发生微弱的电离——水是极弱电解质,所以生成的碱应为NaOH:
,发生了氧化还原反应,从价态变化看,应该是+1价H原子得到了-1价H原子的电子。又由于H2O可以发生微弱的电离——水是极弱电解质,所以生成的碱应为NaOH:
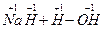 ====NaOH+H2↑
====NaOH+H2↑
(正、负相互吸引,一种化合价的正价原子或原子团跟另一种化合物中的负价原子或原子团重新结合)用化合价升降总值相等验证,也是合理的。
H2既是氧化产物,又是还原产物。
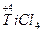

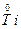 ,Ti元素价态降低,得电子,是氧化剂,NaH和TiCl4反应,谁的价态升高?显然是还原性的H-,Ti已变为单质,Na、H、Cl三元素如何结合?生成NaCl、HCl是必然结果:
,Ti元素价态降低,得电子,是氧化剂,NaH和TiCl4反应,谁的价态升高?显然是还原性的H-,Ti已变为单质,Na、H、Cl三元素如何结合?生成NaCl、HCl是必然结果:2
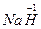 +
+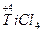 (原子的重新组合)
(原子的重新组合)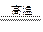 2NaCl+2
2NaCl+2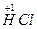 ↑+
↑+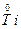 ,用化合价升降总值相等进行验证,十分合理。
,用化合价升降总值相等进行验证,十分合理。(2)
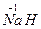 与
与 反应生成
反应生成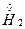 ,发生了氧化还原反应,从价态变化看,应该是+1价H原子得到了-1价H原子的电子。又由于H2O可以发生微弱的电离——水是极弱电解质,所以生成的碱应为NaOH:
,发生了氧化还原反应,从价态变化看,应该是+1价H原子得到了-1价H原子的电子。又由于H2O可以发生微弱的电离——水是极弱电解质,所以生成的碱应为NaOH: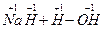 ====NaOH+H2↑
====NaOH+H2↑(正、负相互吸引,一种化合价的正价原子或原子团跟另一种化合物中的负价原子或原子团重新结合)用化合价升降总值相等验证,也是合理的。
H2既是氧化产物,又是还原产物。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
 、K
、K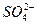 、Cl-四种离子,其中离子个数比n(Na+)∶n(Mg2+)∶n(Cl-)4∶5∶8,若设Na+为4a个,测
、Cl-四种离子,其中离子个数比n(Na+)∶n(Mg2+)∶n(Cl-)4∶5∶8,若设Na+为4a个,测