题目内容
1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8 g,把它投入100 g水中,在常温下放出氢气0.2 g,求:
(1)金属钠的纯度为多少?
(2)被氧化的金属钠的质量为多少?
(3)生成氢氧化钠的质量。
(4)所得溶液中溶质的质量分数。
(1)金属钠的纯度为多少?
(2)被氧化的金属钠的质量为多少?
(3)生成氢氧化钠的质量。
(4)所得溶液中溶质的质量分数。
设10.8 g反应物中含金属钠的质量为x,根据:
2Na+2H2O 2NaOH+H2↑
2NaOH+H2↑
23×2 40×2 2
x y 0.2 g
x=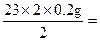 4.6 g
4.6 g
y=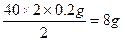
(1)金属钠的纯度: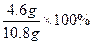 =42.59%
=42.59%
(2)反应物中含氧化钠:m(Na2O)="10.8" g-4.6 g="6.2" g
氧化钠中钠元素(即被氧化的钠)的质量为z。
62∶46="6.2" g∶z z="4.6" g
(3)设氧化钠溶于水生成的氢氧化钠的质量为b。
Na2O+H2O 2NaOH
2NaOH
62 2×40
6.2 g b
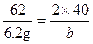 b="8" g
b="8" g
m(NaOH)="8" g+8 g="16" g
(4)计算溶质的质量分数,必须求出反应后溶液的总质量,根据质量守恒关系,
m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)="100" g+10.8 g-0.2 g="110.6" g
溶质的质量分数为: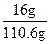 ×100%=14.47%
×100%=14.47%
答:(1)金属钠的纯度为42.59%。
(2)被氧化的金属钠的质量为4.6 g。
(3)生成的氢氧化钠的质量为16 g。
(4)溶质的质量分数为14.47%。
2Na+2H2O
 2NaOH+H2↑
2NaOH+H2↑23×2 40×2 2
x y 0.2 g
x=
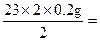 4.6 g
4.6 gy=
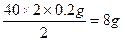
(1)金属钠的纯度:
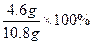 =42.59%
=42.59%(2)反应物中含氧化钠:m(Na2O)="10.8" g-4.6 g="6.2" g
氧化钠中钠元素(即被氧化的钠)的质量为z。
62∶46="6.2" g∶z z="4.6" g
(3)设氧化钠溶于水生成的氢氧化钠的质量为b。
Na2O+H2O
 2NaOH
2NaOH62 2×40
6.2 g b
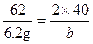 b="8" g
b="8" gm(NaOH)="8" g+8 g="16" g
(4)计算溶质的质量分数,必须求出反应后溶液的总质量,根据质量守恒关系,
m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)="100" g+10.8 g-0.2 g="110.6" g
溶质的质量分数为:
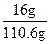 ×100%=14.47%
×100%=14.47%答:(1)金属钠的纯度为42.59%。
(2)被氧化的金属钠的质量为4.6 g。
(3)生成的氢氧化钠的质量为16 g。
(4)溶质的质量分数为14.47%。
10.8 g固体反应物实际上是金属钠和氧化钠的混合物,其中只有金属钠能与水反应产生氢气。而氢氧化钠是钠、氧化钠与水反应的共同产物。根据反应的化学方程式,从放出氢气的质量可求出金属钠的质量及氧化钠的质量。
解题时要注意的是:金属钠溶于水所得溶液的溶质是氢氧化钠而不是金属钠。在计算溶液中溶质的质量分数而求算溶液质量时,不能忽略反应中产生的氢气的质量,即从溶液质量中将其减去才能求出正确的溶液质量。
还须注意的是:被氧化的金属钠的质量不能理解为被氧化生成的氧化钠的质量,应先求出氧化钠的质量,再求出其中所含钠元素的质量,这才是被氧化的金属钠的质量。
解题时要注意的是:金属钠溶于水所得溶液的溶质是氢氧化钠而不是金属钠。在计算溶液中溶质的质量分数而求算溶液质量时,不能忽略反应中产生的氢气的质量,即从溶液质量中将其减去才能求出正确的溶液质量。
还须注意的是:被氧化的金属钠的质量不能理解为被氧化生成的氧化钠的质量,应先求出氧化钠的质量,再求出其中所含钠元素的质量,这才是被氧化的金属钠的质量。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目