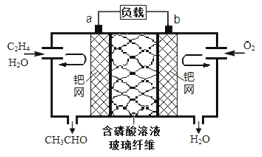
ЬтФПФкШн
ЁОЬтФПЁПНёгаЂйCH3COOH ЂкHCl ЂлH2SO4Ш§жжШмвКЁЃИљОнвЊЧѓЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЕБЫќУЧpHЯрЭЌЪБЃЌЦфЮяжЪЕФСПХЈЖШзюДѓЕФЪЧ (ЬюађКХ)
ЃЈ2ЃЉЕБЫќУЧЕФЮяжЪЕФСПХЈЖШЯрЭЌЪБЃЌЦфpHзюаЁЪЧ (ЬюађКХ)
ЃЈ3ЃЉНЋc(H+)ЯрЭЌЕФШ§жжЫсОљМгЫЎЯЁЪЭжСдРДЕФ10БЖЃЌc(H+)гЩДѓЕНаЁЕФЫГађЮЊ (ЬюађКХ)ЁЃ
ЃЈ4ЃЉЬхЛ§КЭЮяжЪЕФСПХЈЖШОљЯрЭЌЕФЂйЂкЂлШ§жжЫсШмвКЃЌЗжБ№гыЯрЭЌХЈЖШЕФЩеМюШмвКЧЁКУЭъШЋЗДгІЃЌЫљашЩеМюЕФЬхЛ§БШЮЊ ЃЛДЫЪБЫљЕУЕНЕФШ§жжШмвКЕФpHДѓаЁЙиЯЕЮЊ ЃЎ
ЃЈ5ЃЉШєЫсадFeCl2ЗЯвКжаc(Fe2+)=2.0ЁС10-2molЁЄL-1, c(Fe3ЃЋ)=1.0ЁС10-3molЁЄL-1, c(Ѓ)=5.3ЁС10-2molЁЄL-1,дђИУШмвКЕФPHдМЮЊ ЁЃ
ЃЈ6ЃЉFeCl3ПЩзіОЛЫЎМСЃЌОЛЫЎдРэЪЧ (гУРызгЗНГЬЪНБэДя)ЃЌFeCl3ШмвКжаЕФРызгХЈЖШДгДѓЕНаЁЫГађЪЧ
ЁОД№АИЁП
ЃЈ1ЃЉЂйЃЛЃЈ2ЃЉЂлЃЛЃЈ3ЃЉЂй>Ђк=ЂлЃЛ
ЃЈ4ЃЉ1:1:2ЃЛЂй>Ђк=ЂлЃЛЃЈ5ЃЉ2ЃЛ
ЃЈ6ЃЉFe3++3H2O![]() FeOH)3(НКЬх)+3H+ЃЛc(Cl-)>c(Fe3+)>c(H+)>c(OH-)ЃЛ
FeOH)3(НКЬх)+3H+ЃЛc(Cl-)>c(Fe3+)>c(H+)>c(OH-)ЃЛ
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉЕБЫќУЧpHЯрЭЌЪБЃЌШмвКжаЧтРызгХЈЖШЯрЭЌЃЌМйЩшЬсЙЉ1mol/LЕФЧтРызгЃЌашвЊДзЫсХЈЖШгІДѓгк1mol/LЃЛашвЊЂкHClШмвКХЈЖШЮЊ1mol/LЃЛашвЊЂлH2SO4 ШмвКХЈЖШЮЊ0.5mol/LЃЌдђЮяжЪЕФСПХЈЖШзюДѓЕФЮЊЂйЃЌЙЪД№АИЮЊЃКЂйЃЛ
ЃЈ2ЃЉЕБЫќУЧЕФЮяжЪЕФСПХЈЖШЯрЭЌЪБЃЌМйЩшХЈЖШЖМЪЧ1mol/LЃКЂйCH3COOHШмвКЕчРыГіЧтРызгХЈЖШаЁгк1mol/LЃЌЂкHClЕчРыГіЧтРызгХЈЖШЮЊ1mol/LЃЌЂлH2SO4ЕчРыГіЕФЧтРызгХЈЖШЮЊ2mol/LЃЌЧтРызгХЈЖШдНДѓЃЌШмвКЕФpHдНаЁЃЌдђШмвКЕФpHзюаЁЕФЮЊЂлЃЌЙЪД№АИЮЊЃКЂлЃЛ
ЃЈ3ЃЉДзЫсЪЧШѕЕчНтжЪМгЫЎЯЁЪЭДйНјЕчРыЃЌЫљвдЯЁЪЭКѓДзЫсЧтРызгХЈЖШзюДѓЃЌЖјбЮЫсКЭСђЫсЧтРызгЕФХЈЖШжЛМѕаЁЧвЯрЕШЃЌЫљвдc(H+)гЩДѓЕНаЁЕФЫГађЮЊЃКЂйЃОЂк=ЂлЃЌЙЪД№АИЮЊЃКЂйЃОЂк=ЂлЃЛ
ЃЈ4ЃЉЬхЛ§КЭЮяжЪЕФСПХЈЖШОљЯрЭЌЕФЂйЂкЂлШ§жжЫсШмвКЃЌДзЫсКЭбЮЫсЪЧвЛдЊЫсЃЌСђЫсЪЧЖўдЊЫсЃЌЗжБ№гыЯрЭЌХЈЖШЕФЩеМюШмвКЧЁКУЭъШЋЗДгІЃЌЫљашЩеМюЕФЬхЛ§БШЮЊ1ЃК1ЃК2ЃЛбЮЫсКЭСђЫсЪЧЧПЫсЃЌДзЫсЪЧШѕЫсЃЌШѕЫсЧПМюбЮЫЎНтЯдМюадЃЌЧПЫсЧПМюбЮВЛЫЎНтЃЌШмвКЯджаадЃЌШ§жжШмвКЕФpHДѓаЁЙиЯЕЮЊЂйЃОЂк=ЂлЃЌЙЪД№АИЮЊЃК1ЃК1ЃК2ЃЛЂйЃОЂк=ЂлЃЛ
ЃЈ5ЃЉИљОнЕчКЩЪиКуЃКc(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(ЫсадШмвКжаOH-ХЈЖШКмаЁЃЌдкетРяПЩвдКіТдВЛМЦ)ЃЌдђc(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0ЁС10-2molL-1ЃЌдђШмвКpH=-lg1.0ЁС10-2=2ЃЌЙЪД№АИЮЊЃК2ЃЛ
ЃЈ6ЃЉFeCl3ЫЎНтЩњГЩЕФЧтбѕЛЏЬњНКЬхОпгаЮќИНадЃЌФмЙЛЮќИНЫЎжаЕФаќИЁЮяЃЌЦ№ЕНОЛЫЎЕФзїгУЃЌРызгЗНГЬЪНЮЊFe3+ + 3H2O![]() FeOH)3 (НКЬх)+ 3H+ЃЌFeCl3ШмвКжаЕФРызгХЈЖШДгДѓЕНаЁЫГађЮЊc(Cl-)> c(Fe3+)>c(H+)> c(OH-)ЃЌЙЪД№АИЮЊЃКFe3+ + 3H2O
FeOH)3 (НКЬх)+ 3H+ЃЌFeCl3ШмвКжаЕФРызгХЈЖШДгДѓЕНаЁЫГађЮЊc(Cl-)> c(Fe3+)>c(H+)> c(OH-)ЃЌЙЪД№АИЮЊЃКFe3+ + 3H2O![]() FeOH)3 (НКЬх)+ 3H+ЃЛc(Cl-)> c(Fe3+)>c(H+)> c(OH-)ЁЃ
FeOH)3 (НКЬх)+ 3H+ЃЛc(Cl-)> c(Fe3+)>c(H+)> c(OH-)ЁЃ