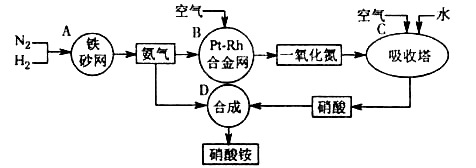
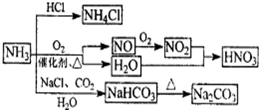
��Ŀ����
ijʵ��С�����������װ�ý��а��Ĵ�����ʵ�顣
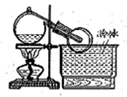
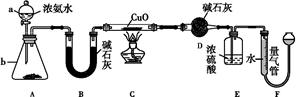
��1�������£���5��8 mol/L�İ�ˮʱʵ���������ԣ�����Ũ��ˮ���Ƹ�Ũ�ȵİ�ˮ480mL����Ҫ�ձ���������������Ҫ�IJ��������� ��
��2���״�ҩƷ������Ϊ_____________��
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��_____��������š����ȷ�Ӧ����ѧ����ʽΪ ���Ҵ�������ˮ�Ȼ��ƣ���ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ___ ����ƿ�в���������Ϊ _��
��4�����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в���������Ϊ ��
��5������þ��ʯī���缫��Ũ�Ȼ����Һ�����Һ����ԭ��أ������ĵ缫��ӦʽΪ ��

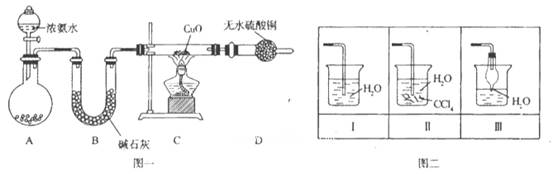
��1�������£���5��8 mol/L�İ�ˮʱʵ���������ԣ�����Ũ��ˮ���Ƹ�Ũ�ȵİ�ˮ480mL����Ҫ�ձ���������������Ҫ�IJ��������� ��
��2���״�ҩƷ������Ϊ_____________��
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��_____��������š����ȷ�Ӧ����ѧ����ʽΪ ���Ҵ�������ˮ�Ȼ��ƣ���ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ___ ����ƿ�в���������Ϊ _��
��4�����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в���������Ϊ ��
��5������þ��ʯī���缫��Ũ�Ȼ����Һ�����Һ����ԭ��أ������ĵ缫��ӦʽΪ ��
��1����Ͳ����ͷ�ιܡ�500mL����ƿ ��2�֣�ȱһ���1�֣�
��2����ʯ�ң�2�֣���
��3�����ȷ�Ӧ��1�֣��� 4NH3��5O2 4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
��4���к���ɫ�������ɣ��������̣�2�֣���1�֣�
��5��2 NH4++ 2e����2NH3��+H2����2�֣���
��2����ʯ�ң�2�֣���
��3�����ȷ�Ӧ��1�֣��� 4NH3��5O2
 4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣��� ��4���к���ɫ�������ɣ��������̣�2�֣���1�֣�
��5��2 NH4++ 2e����2NH3��+H2����2�֣���
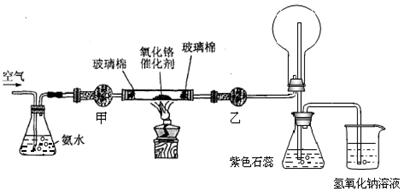
�����������1������һ�����ʵ���Ũ�ȵİ�ˮ����Ҫ������Ͳ��ȡŨ��ˮ����Һ���480 mL����Ҫ500 mL����ƿ������õ���ͷ�ιܶ��ݣ���2�����ﰱ���ü�ʯ�ң���3����Ԥ�ȣ�������Ӧ��Ȼ��ֹͣ���ȣ���Ӧ��Ȼ���Խ��У�˵���÷�Ӧ�Ƿ��ȷ�Ӧ�����Ĵ���������NO��ˮ��NO������ƿ��������Ӧ����NO2����ɫ���壬��ƿ�е��ܿ������ݲ�����ͬʱ��Һ��Ϊ��ɫ��Һ���Ϸ����ֺ���ɫ���壻��4�����ȱ���Ҵ�����ˮ�Ȼ��Ƶĸ��NO��ˮ�Ͱ����ͻ������ƿ�У�NO���������ɺ���ɫ����NO2��NO2��ˮ��Ӧ�������ᣬ�����백����Ӧ��������粒��壬�ῴ�����̣���5���������¹���ԭ��أ������Ϊˮ�������Ե��Ȼ����Һ������Ϊþʧ���ӣ�������H+ �õ��ӣ�OH-���࣬���������Լ��ԣ�������εļ�⣬�а����ų�����������ӦΪ��2 NH4++ 2e����2NH3��+H2����

��ϰ��ϵ�д�
 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
�����Ŀ
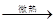 NaHSO4+HNO3�������������ΪHNO3
NaHSO4+HNO3�������������ΪHNO3