题目内容
4.在4℃时,100mL水中溶解了22.4L HCl气体(标准状况)后形成盐酸溶液.下列关于该溶液的说法中正确的是( )| A. | 该溶液物质的量浓度为10mol•L-1 | |
| B. | 该溶液物质的量浓度因溶液的密度未知而无法求得 | |
| C. | 所得溶液的体积为22.5L | |
| D. | 按所给条件该溶液中溶质的质量分数无法求得 |
分析 A.标准状况下22.4LHCl的物质的量为1mol,根据题目信息无法计算溶液的体积;
B.因溶液的密度未知,无法计算溶液的体积;
C.溶液体积不等于溶剂与溶质的体积之和,利用V=$\frac{m}{ρ}$计算溶液体积;
D.溶液质量=溶质质量+溶剂质量,溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%,据此计算.
解答 解:A.标准状况下22.4LHCl的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,溶于水配成100mL溶液,溶液的浓度为10mol/L,溶液体积为100mL,不是溶剂的体积,因溶液的密度未知,无法计算溶液的体积,无计算该溶液的物质的量浓度,故A错误;
B.因溶液的密度未知,无法计算溶液的体积,则无计算该溶液的物质的量浓度,故B正确;
C.溶液体积不等于溶剂与溶质的体积之和,因溶液的密度未知,无法计算溶液的体积,故C错误;
D.标准状况下22.4LHCl的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,质量为:36.5g/mol×1mol=36.5g,4℃时100mL水的质量为100g,所以溶液溶质的质量分数为$\frac{36.5g}{36.5g+100g}$×100%=26.74%,故D错误;
故选B.
点评 本题考查物质的量与其浓度和摩尔体积的综合应用,题目难度中等,注意掌握物质的量浓度理解及与质量分数的关系,试题侧重考查学生的分析、理解能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 10g重水(2H216O)中含有的中子数目为5NA | |
| B. | 28g氮气所含有的原子数目为NA | |
| C. | 标准状况下,2.24L水中含有的水分子数目为0.1NA | |
| D. | 1mol铁与足量稀盐酸反应转移的电子数目为3NA |
15.现有部分短周期元素的性质或原子结构如下表:
(1)元素T在周期表中的位置是第三周期VIA族;
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
12.下列叙述中正确的是( )
| A. | 硫酸的摩尔质量是98g | |
| B. | 铁原子的摩尔质量等于铁的相对原子质量 | |
| C. | 标准状况下,22.4L的O2质量是32g | |
| D. | 2gH2所含原子物质的量为1mol |
19.某无色混合气体中可能含有Cl2、SO2、NO、NO2、N2中的一种或几种.现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色.下列对于原混合气体成分的判断中正确的是( )
| A. | 肯定有Cl2和SO2 | B. | 肯定有SO2和NO | C. | 可能有Cl2和N2 | D. | 肯定有SO2和NO2 |
9.在元素周期表中,同主族元素原子具有相同的( )
| A. | 电子层数 | B. | 核外电子数 | C. | 最外层电子数 | D. | 核电荷数 |
16.下列实验事实能说明苯分子没有与乙烯类似的双键的是( )
①用冰冷却试管中的苯,凝结成无色晶体
②点燃苯,火焰明亮并带有浓烈黑烟
③向试管中加入少量苯,再加入酸性高锰酸钾溶液,振荡后,没有明显变化
④向试管中加入少量苯,再加入溴水,振荡后,上层呈橙红色,下层几乎无色.
①用冰冷却试管中的苯,凝结成无色晶体
②点燃苯,火焰明亮并带有浓烈黑烟
③向试管中加入少量苯,再加入酸性高锰酸钾溶液,振荡后,没有明显变化
④向试管中加入少量苯,再加入溴水,振荡后,上层呈橙红色,下层几乎无色.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
14.下列叙述中,正确的是( )
| A. | 用玻璃棒搅拌漏斗中的液体可以加快过滤的速度 | |
| B. | 用澄清的石灰水可鉴别CO2和SO2 | |
| C. | 某元素从化合态变为游离态时,该元素可能被氧化也可能被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
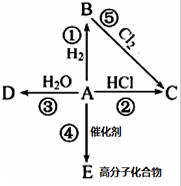 烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
烃A(乙烯)是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: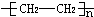 ;
;