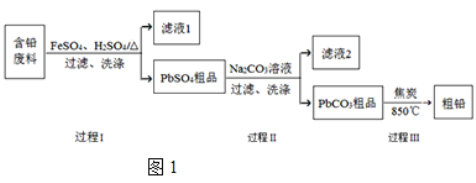
题目内容
【题目】下表列出了①~⑧八种元素在周期表中的位置:
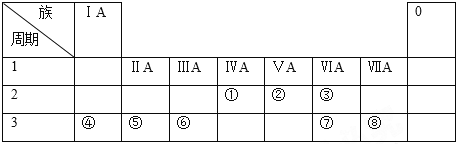
请回答下列问题:
(1)①、②、③三种元素中非金属性最强的是_________(用元素符号表示)。
(2)④、⑥两种元素的最高价氧化物的水化物在溶液中相互反应的化学方程式____________________________________。
(3)画出⑤的原子结构示意图____________。
(4)⑦、⑧两种元素原子半径大小比较__________(用元素符号表示)。
(5)画出⑧的氢化物的电子式____________。
【答案】 O Al(OH)3+NaOH=NaAlO2+2H2O 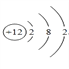 S>Cl
S>Cl ![]()
【解析】根据元素在周期表中的相对位置可知①~⑧分别是C、N、O、Na、Mg、Al、S、Cl,则
(1)同周期自左向右非金属性逐渐增强,①、②、③三种元素中非金属性最强的是O。(2)④、⑥两种元素的最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,其中氢氧化铝是两性氢氧化物,在溶液中相互反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。(3)镁的原子序数是12,原子结构示意图为 。(4)同周期自左向右原子半径逐渐减小,⑦、⑧两种元素原子半径大小比较为S>Cl。(5)⑧的氢化物是氯化氢,含有共价键的共价化合物,电子式为
。(4)同周期自左向右原子半径逐渐减小,⑦、⑧两种元素原子半径大小比较为S>Cl。(5)⑧的氢化物是氯化氢,含有共价键的共价化合物,电子式为![]() 。
。

练习册系列答案
相关题目