题目内容
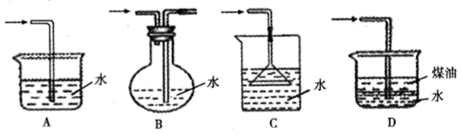
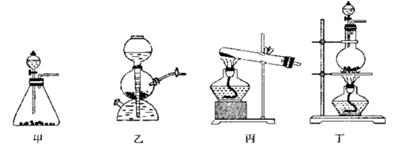
(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
①气体X的分子式是 。
②所选择的药品a是 ,b是 , c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)

④请写出在试管a中所发生反应的化学方程式 。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出 ; ;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象: 。
回答下列问题:

①气体X的分子式是 。
②所选择的药品a是 ,b是 , c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)

④请写出在试管a中所发生反应的化学方程式 。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出 ; ;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象: 。
(1) ① NO ② a稀硝酸 b铜屑 c蒸馏水 ③乙
④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色,又变无色;
(2)不正确 依据是:铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同。
方案及实验现象:将绿色溶液加热,有红棕色气体产生,溶液变成蓝色,说明后一种推断正确。或:将溶液稀释,溶液变蓝色(其它合理方案均可)
④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色,又变无色;
(2)不正确 依据是:铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同。
方案及实验现象:将绿色溶液加热,有红棕色气体产生,溶液变成蓝色,说明后一种推断正确。或:将溶液稀释,溶液变蓝色(其它合理方案均可)
(1)①结合所给试剂可看出,可以制取的气体包括H2S、SO2、CO2、NO、NO2等,再结合所给装置,在不加热的情况下能制取的不溶于水的气体只有NO
②依据反应原理3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知, a稀硝酸 b铜屑;而为水,可除去NO中的NO2
③NO只能用排水法来收集,故选乙装置即可
④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色:2NO+O2=2NO2,又变无色3NO2+H2O=2HNO3+NO;
(2)铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同,不可能导致溶液颜色的不同
假如溶液呈绿色是由Cu2+与NO2混合的结果,可加热使NO2逸出,可将溶液稀释(3NO2+H2O=2HNO3+NO)即可
②依据反应原理3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知, a稀硝酸 b铜屑;而为水,可除去NO中的NO2
③NO只能用排水法来收集,故选乙装置即可
④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色:2NO+O2=2NO2,又变无色3NO2+H2O=2HNO3+NO;
(2)铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同,不可能导致溶液颜色的不同
假如溶液呈绿色是由Cu2+与NO2混合的结果,可加热使NO2逸出,可将溶液稀释(3NO2+H2O=2HNO3+NO)即可

练习册系列答案
相关题目
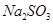 已被氧化(简述实验步骤):
已被氧化(简述实验步骤):