��Ŀ����
20�� ���ú˴Ź������ⶨ�л�����ӵ���ά�ṹ���о������2002��ŵ������ѧ����
���ú˴Ź������ⶨ�л�����ӵ���ά�ṹ���о������2002��ŵ������ѧ������1�����������У���˴Ź��������и����ķ�ֵ���źţ�ֻ��һ������AD��
A��CH3CH3 B��CH3COOH C��CH3COOCH3 D��CH3OCH3
��2��������A��B�ķ���ʽ����C2H4Br2��A�ĺ˴Ź�������ͼ����ͼ��ʾ����A�Ľṹ��ʽΪ��BrCH2CH2Br��
��3��5.8gij�л�����ȫȼ�գ�ֻ����CO2��H2O�����������Ϊ1��1��ͬѹͬ�£����ѻ������ͨ����ʯ�ң�������������18.6g����ͬ�������л�����0.1mol������ȫ����������Ӧ����֪���л���Կ���������ܶ�Ϊ2��
���л������Է�������58�����л���ķ���ʽC3H6O��
�۸��л���˴Ź���������ʾ��4�����շ壬�����֮��Ϊ��1��2��1��2������л���Ľṹ��ʽCH2�TCHCH2OH��
���� ��1���˴Ź��������з�ֵ�������л�������ԭ�ӵ����������˴Ź��������и����ķ�ֵ���źţ�ֻ��һ����˵���÷�����ֻ��1��Hԭ�ӣ�
��2���˴Ź��������з�ֵ�������л�������ԭ�ӵ����������˴Ź���������ֻ����һ�ַ壬˵���÷�����ֻ��1��Hԭ�ӣ�Ȼ����ݷ���ʽд����Ӧ�Ľṹ��
��3���ٸ��л���Կ���������ܶ�Ϊ2�����л�����Է�������=29��2=58��
��5.8g�л�������ʵ���Ϊ0.1mol��ȼ������CO2��H2O���������Ϊ1��1����ʯ��������18.6gΪCO2��H2O������������������ʵ���������ԭ���غ���������C��Hԭ����Ŀ���ٸ�����Է�����������Oԭ����Ŀ������ȷ���л������ʽ��
����4�����շ壬�����֮��Ϊ��1��2��1��2��˵����4����ԭ�ӣ���ԭ�Ӹ���֮��Ϊ��2��1��2��
��� �⣺��1��A��CH3CH3��ֻ��һ��Hԭ�ӣ���A��ȷ��
B��CH3COOH��������Hԭ�ӣ���B����
C��CH3COOCH3��������Hԭ�ӣ���C����
D��CH3OCH3��ֻ��һ��Hԭ�ӣ���D��ȷ����ѡ��AD��
��2���˴Ź���������ֻ����һ�ַ壬˵���÷�����ֻ��1��Hԭ�ӣ���A�Ľṹ��ʽΪBrCH2CH2Br��B�Ľṹ��ʽΪCH3CHBr2��������Hԭ�ӣ����Ժ˴Ź�����������2���壬
�ʴ�Ϊ��BrCH2CH2Br��
��3���ٿ�����ƽ��������Ϊ29������ܶ�����Է������������ȣ����л���Կ���������ܶ�Ϊ2�����л�����Է�������Ϊ��29��2=58��
�𣺸��л������Է�������Ϊ58��
��5.8g�л�������ʵ���Ϊ��$\frac{5.8g}{58g/mol}$=0.1mol����ȫȼ������CO2��H2O���������Ϊ1��1����ʯ��������18.6gΪCO2��H2O����������18n��H2O��+44n��CO2��=18.6����ã�n��CO2��=n��H2O��=$\frac{18.6}{44n+18n}$mol=0.3mol��
����������N��C��=$\frac{0.3mol}{0.1mol}$�T3��N��H��=$\frac{0.3mol��2}{0.1mol}$=6��N��O��=$\frac{58-12��3-6}{16}$=1��
���л������ʽΪ��C3H6O��
�ʴ�Ϊ��C3H6O��
����4�����շ壬�����֮��Ϊ��1��2��1��2��˵����4����ԭ�ӣ���ԭ�Ӹ���֮��Ϊ��2��1��2���ṹ��ʽCH2�TCHCH2OH���ʴ�Ϊ��CH2�TCHCH2OH��
���� �����Ϻ˴Ź������������л���ṹ����д���л������ʽ��ȷ������Ŀ�Ѷ��еȣ���ȷ����ܶ�����Է��������Ĺ�ϵΪ���ؼ���ע�����������غ���ȷ���л������ʽ�е�Ӧ�÷�����

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�| A�� | 612C��613C | B�� | O2��O3 | C�� | H2O��H2O2 | D�� | CO��CO2 |
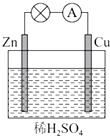 ��ͼ��ʾ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨�ϵļ�¼���£���Ƭ�������������ǣ�������
��ͼ��ʾ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨�ϵļ�¼���£���Ƭ�������������ǣ�������| A�� | CuΪ������ZnΪ���� | B�� | Cu���������ݲ�����������ԭ��Ӧ | ||
| C�� | SO42-��Cu���ƶ� | D�� | ���ӵ������ǣ�Cu-��Zn |
| A�� | K+��I-��Cl-��SO42- | B�� | Fe2+��Na+��Mg2+��Cl- | ||
| C�� | SO32-��Na+��K+��NO3- | D�� | NH4+��K+��AlO2-��NO3- |
��1��CH3COOH��l��+2O2��g���T2CO2��g��+2H2O��l����H1=-870.3kJ•mol-1
��2��C��s��+O2��g���TCO2��g����H2=-393.5kJ•mol-1
��3��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H3=-285.8kJ•mol-1
�����з�Ӧ�ķ�Ӧ��Ϊ��������
2C��s��+2H2��g��+O2��g���TCH3COOH��l��
| A�� | ��H=+488.3 kJ•mol-1 | B�� | ��H=-244.15 kJ•mol-1 | ||
| C�� | ��H=-977.6 kJ•mol-1 | D�� | ��H=-488.3 kJ•mol-1 |
 ��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺
��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺