题目内容
20.由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Fe3+)=0.3mol/L,c(SO${\;}_{4}^{2-}$)=0.6mol/L,则c(K+)为0.2mol/L.分析 溶液呈电中性,根据电荷守恒可知:c(K+)+c(H+)+3c(Fe3+)=2c(SO42-),据此计算出溶液中钾离子的物质的量浓度.
解答 解:溶液呈电中性,根据电荷守恒可知:c(K+)+c(H+)+3c(Fe3+)=2c(SO42-),
则:c(K+)+0.1mol/L+3×0.3mol/L=2×0.6mol/L,
解得c(K+)=0.2mol/L,
故答案为:0.2mol/L.
点评 本题考查物质的量浓度有关计算,题目难度不大,电解质混合溶液中常利用电荷守恒计算离子物质的量及其浓度,试题培养了学生的化学计算能力.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
11. 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
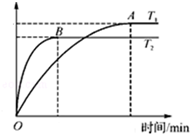
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆(填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
15.下列反应的离子方程式书写正确的是( )
| A. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向硫酸铜溶液中加入氢氧化钡溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 将Cu丝插入AgNO3溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 向KHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:2H++SO${\;}_{4}^{2-}$+Ba2++2OH-═2H2O+BaSO4↓ |
12.用Na2CO3粉末配制1mol/L的Na2CO3100mL,配制中需用仪器的先后顺序是( )
①托盘天平 ②量筒 ③50mL烧杯 ④药匙 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
①托盘天平 ②量筒 ③50mL烧杯 ④药匙 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒.
| A. | ①③⑤⑥⑦ | B. | ④①③⑦⑤⑥ | C. | ④①⑤⑦⑥ | D. | ④②③⑦⑤⑥ |
9.下列叙述中正确的是( )
| A. | 离子晶体中肯定不含共价键 | B. | 离子晶体都易溶于水 | ||
| C. | 分子晶体的熔、沸点一般较低 | D. | 原子晶体键长越大,键能越大 |
10.下列说法正确的是( )
| A. | 反应能否自发进行与温度无关 | |
| B. | 能自发进行的化学反应,一定是△H>0、△S>0 | |
| C. | 放热反应一定都是自发的 | |
| D. | 电解池的反应不属于自发过程 |
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.X与Y能形成多种化合物,其中一种含有10电子的化合物是CH4,该化合物可与氧气在碱性溶液的条件下形成原电池供能,写出负极涉及的电极方程式CH4-8e-+10OH-=CO32-+7H2O.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.X与Y能形成多种化合物,其中一种含有10电子的化合物是CH4,该化合物可与氧气在碱性溶液的条件下形成原电池供能,写出负极涉及的电极方程式CH4-8e-+10OH-=CO32-+7H2O.
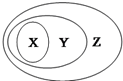 X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是
X、Y、Z可以用如图表示的一些物质或概念间的从属关系中正确的是