题目内容
铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是 。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
①铝的电负性χ的范围是 。
②电负性的数值与元素金属性的关系是 。
③下列实验能比较镁和铝的金属性强弱的是 。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s) ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s) ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
(1)铝在元素周期表中的位置是 。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | χ | 1.8 |
①铝的电负性χ的范围是 。
②电负性的数值与元素金属性的关系是 。
③下列实验能比较镁和铝的金属性强弱的是 。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s) ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s) ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
(14分,每空2分)
(1)第3周期第ⅢA族
(2)①电负性数值越大,元素的金属性越弱
② 1.2<χ<1.8
③ c
(3)4Al(s)+ 3MnO2(s)=3Mn(s)+2Al2O3(s) ΔH=–1789 kJ/mol
(4)阴
在阳极发生反应2O2-– 4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充
(1)第3周期第ⅢA族
(2)①电负性数值越大,元素的金属性越弱
② 1.2<χ<1.8
③ c
(3)4Al(s)+ 3MnO2(s)=3Mn(s)+2Al2O3(s) ΔH=–1789 kJ/mol
(4)阴
在阳极发生反应2O2-– 4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充
试题分析:(1)Al为13号元素,位于第3周期第ⅢA族。
(2)①根据电负性的变化规律,铝的电负性介于Mg和Si之间。
②电负性数值越大,原子对电子吸引能力越大,失电子越难,所以金属性越弱。
③a、导电性与电负性无关,错误;b、等物质的量浓度的Al2(SO4)3和MgSO4溶液,SO42?浓度不同,错误;c、加过量NaOH溶液,AlCl3溶液先出现沉淀后溶解,说明Al(OH)3呈两性,金属性弱于Mg,正确。
(3)首先写出化学方程式,注明状态,然后根据盖斯定律求焓变:?H=?H1–3?H2=" –1789" kJ?mol?1,进而写出热化学方程式。
(4)Al3+在阴极得电子生成Al;阳极O2?得电子生成O2,在较高温度下与石墨反应生成CO2,石墨电池被消耗,所以需要不断补充。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
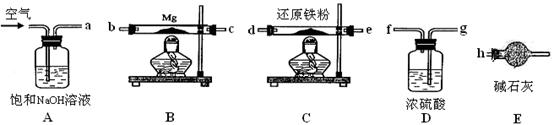
 MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑