题目内容
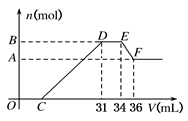
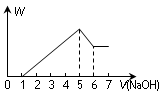
H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42—的物质的量之比为( )

| A.1∶1∶1 | B.5∶3∶2 | C.2∶1∶5 | D.3∶2∶2 |
C
试题分析:H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,先发生的是酸碱中和,然后产生了氢氧化铝和氢氧化镁沉淀,最后氢氧化铝溶解,其离子方程式分别为
H++OH-=H2O、Al3++4OH-=AlO2-+2H2O、Mg2++2OH-=Mg(OH)2↓,由图可以知道,设1V积极的氢氧化钠的含量为amol,刚开始为酸碱的中和,所以酸的物质的量为0.5amol,因为Al(OH)3+OH-=AlO2-,有图可以知道铝的物质的量为amol,所以消耗镁的氢氧化钠为6amol-4amol-amol=amol,所以Mg2+的物质的量为0.5amol,所以Al3+、Mg2+和SO42—的物质的量分别为amol、0.5amol、0.5+1.5+0.5=2.5amol,即Al3+、Mg2+和SO42—的物质的量之比为2∶1∶5,所以本题的答案选择C。
点评:本题考查了元素及其化合物,涉及考查了铝及其化合物的性质,该考点是高考考点的重点,本题有一定的难度。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目