题目内容
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),则N2H4完全燃烧反应的热化学方程式是___________________________________________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是______________________________。负极的电极反应式是_____________________________。
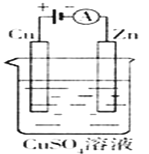
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是___________________。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气__________L(假设空气中氧气体积含量为20%)
【答案】N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol O2+2H2O+4e-=4OH- N2H4+4OH--4e-=4H2O+N2↑ Cu2++2e-=Cu 112
【解析】
(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;
(3)①电解池的负极上是阳离子发生得电子的还原反应;②根据电极反应,结合电子守恒和空气的组成情况来回答。
(1))32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-
=4H2O+N2↑;
(3)①电解池的负极上是阳离子铜离子发生得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,故答案为:112。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案



