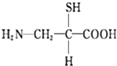
题目内容
10.加热10.0g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g.(1)求混合物中碳酸氢钠的物质的量.
(2)求混合物中碳酸钠的质量分数.
分析 加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,利用差量法,根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O计算碳酸氢钠的质量,然后求出碳酸氢钠的物质的量,进而计算碳酸钠的质量分数.
解答 解:加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,则固体质量减少的原因是由于碳酸氢钠分解的缘故,设混合物中碳酸氢钠的质量为m,利用差量法计算,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84g 62g
m 10.0g-8.45g
m=$\frac{2×84g×1.55g}{62g}$=4.2g,
(1)混合物中碳酸氢钠的物质的量为$\frac{4.2g}{84g/mol}$=0.05mol,
答:混合物中碳酸氢钠的物质的量为0.05mol;
(2)混合物中碳酸钠的质量为10.0g-4.2g=5.8g,
混合物中碳酸钠的质量分数为:$\frac{5.8g}{10.0g}$=58%.
答:混合物中碳酸钠的质量分数为58%.
点评 本题考查混合物的计算,题目难度不大,注意根据碳酸氢钠不稳定的性质,利用差量法计算.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
1.PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(Ⅰ)制备:
如图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称为冷凝管,其中与自来水进水管连接的编号是b(填“a”或“b”).
(2)实验室常用软锰矿(MnO2)与浓盐酸制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(4)向仪器甲中通入干燥的Cl2之前,应先通入一段时间的CO2,其目的是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(Ⅱ)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
(Ⅲ)分析:
(6)迅速称取5.5g产品,水解完全后配成500mL溶液,取出25mL,加入过量的0.1mol•L-1碘溶液23mL,充分反应后用0.1mol•L-1Na2S2O3溶液滴定过量的碘,消耗10mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;
假设测定过程中没有发生其他反应.根据上述数据,可计算出该产品中PCl3的质量分数为90.0%.
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3 2P+5Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称为冷凝管,其中与自来水进水管连接的编号是b(填“a”或“b”).
(2)实验室常用软锰矿(MnO2)与浓盐酸制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(4)向仪器甲中通入干燥的Cl2之前,应先通入一段时间的CO2,其目的是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(Ⅱ)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
(Ⅲ)分析:
(6)迅速称取5.5g产品,水解完全后配成500mL溶液,取出25mL,加入过量的0.1mol•L-1碘溶液23mL,充分反应后用0.1mol•L-1Na2S2O3溶液滴定过量的碘,消耗10mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;
假设测定过程中没有发生其他反应.根据上述数据,可计算出该产品中PCl3的质量分数为90.0%.
15.下列物质中,不属于弱电解质的是( )
| A. | CH3CHO | B. | H2CO3 | C. | CH3COOH | D. | H2C2O4 |
2.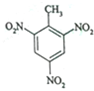 TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
 TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )| A. | TNT分子式为C7H3O6N3 | |
| B. | TNT的名称叫2,4,6-三硝基甲苯 | |
| C. | 每个TNT分子中可共平面的碳原子最多为6个 | |
| D. | 若硝酸的结构可表示为HO-NO2,每摩尔甲苯可取代3mol硝基制得TNT |
19.苯分子中不存在与乙烯类似的双键,苯的化学性质与烯烃有很大的差别,下表列举了苯和乙烯的部分化学性质,请填写空白:
| 有机物 | 无机反应物 | 反应条件 | 反应类型 | 生成物 |
| 乙烯 | Br2 | |||
| 苯 | Br2 | |||
| 苯 | HNO3 |
20.下列关于混合物分离和提纯的说法错误的是( )
| A. | 混合物的分离是将混合物中的两种或多种物质分开 | |
| B. | 混合物的提纯是除去混有的杂质 | |
| C. | 混合物分离和提纯的目的相同 | |
| D. | 混合物的分离和提纯广泛应用于工农业生产以及生活中 |
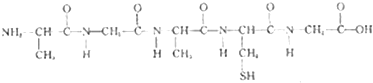
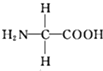 B.
B.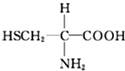
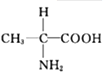 D.
D.