题目内容
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
A
解析试题分析:根据电子排布式可推出①是S, ②是P,③是N,根据元素周期表的递变规律可得,第一电离能:③>②>①,原子半径:②>③>①,电负性:③>①>②,最高正化合价:①>②=③,只有A项正确。
考点:本题考查电子排布式及元素性质的递变规律。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图是元素周期表的一部分,下列关系正确的是
| S | Cl |
| Se | Br |
A.还原性:Se2->S2->C1- B.热稳定性:HC1>H2Se>HBr
C.原子半径:Se>C1>S D.酸性:HBrO4>HClO4>H2SO4
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是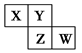
| A.元素W的最高价氧化物对应水化物的酸性最强 |
| B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C.元素Y和元素Z的氢化物中均只存在极性共价键 |
| D.元素Y和元素Z的最高正化合价相同 |
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.Y的氢化物与W的氢化物反应的产物只含有共价键
B.1mol/L的单质参加氧化还原反应时转移的电子数为2mol
C.0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D.X与Z形成XZ2时各原子均满足8电子稳定结构
短周期主族元素X、Y、Z在元素周期表中的相对位置如图,下列推论合理的是
| X | Y |
| | Z |
A.若Y和Z能形成化合物,则X为氮元素
B.若X、Y、Z的单质常温下都是气体,则Y为氧元素
C.若X、Y、Z是非金属元素,则它们气态氢化物的水溶液都显酸性
D.若X、Y、Z的原子序数之和小于20,则它们都是金属元素
短周期元素R、T、Q、W、K在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断正确的是
| | | R | | |
| T | Q | | W | K |
A.原子半径及其最高价氧化物对应水化物的酸性:Q<W<K
B.含元素T的盐溶液一定显酸性
C.最简单气态氢化物沸点和还原性:Q>R
D.最简单气态氢化物的热稳定性和水溶液酸性:K>W
 Cl、
Cl、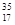 Cl为不同的核素,下列说法正确的是
Cl为不同的核素,下列说法正确的是
A. Cl2的摩尔质量是74 Cl2的摩尔质量是74 |
| B.通常情况下,氯气做氧化剂,但氯气也具有还原性 |
C. Cl、 Cl、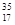 Cl互为同位素, Cl互为同位素,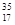 Cl2与 Cl2与 Cl2互为同素异形体 Cl2互为同素异形体 |
D.常温下,4.48L Cl2含有8NA个中子(NA为阿伏加德罗常数的值) Cl2含有8NA个中子(NA为阿伏加德罗常数的值) |
X.Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
| A.酸A中X的化合价比酸B中Y化合价高 |
| B.酸A中X与酸B中Y在同一周期,且X在Y之后 |
| C.酸A与酸B的铵盐溶液反应生成酸B |
| D.酸A具有强氧化性,酸B没有强氧化性 |