题目内容
【题目】二水合重重铬酸钠(Na2Cr2O7.2H2O),[已知M(Na2Cr2O7.2H2O)=298g/mol]俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO.Cr2O3,还含有A1203、MgO、Si02等杂质)为主要原料生产,其主要工艺流程如图:
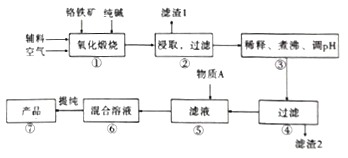
已知信息:
Ⅰ.“①”中涉及的主要反应是:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的PH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液PH | 4.7 | 3.7 | 11.2 | 5.6 |
(1).杂质A12O3、SiO2与纯碱反应转变为可溶性盐,写出A12O3纯碱反应的化学方程式为:______________,滤渣1的主要成分为__________________。
(2).“③”中通过调节PH除去杂质,调节PH至___________。
(3).“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为__________,简述原因:______________________________。(用离子方程式及文字加以说明)
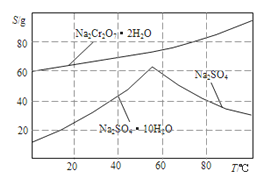
(4).如图是Na2Cr2O3.2H2O和Na2SO4的溶解度曲线。提纯的实验操作:将Na2Cr2O3和Na2SO4的混合溶液______________________,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。
(5).实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,写出离子方程式:________________。然后加水100mL,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-若达到滴定终点时,共用去Na2S2O3标准溶液60mL,所得产品的纯度是_________(结果保留小数点后1位)。
【答案】(1).Al2O3+Na2CO3![]() 2NaAlO2+CO2↑(2分)Fe2O3、MgO(2分)(2).4.7(2分)
2NaAlO2+CO2↑(2分)Fe2O3、MgO(2分)(2).4.7(2分)
(3).H2SO4(1分)2CrO42-![]() Cr2O72-+H2O,加入硫酸,平衡向右移动(1分)
Cr2O72-+H2O,加入硫酸,平衡向右移动(1分)
(4).蒸发浓缩、趁热过滤(5).14H++Cr2O72-=2Cr3+3I2+7H2O(2分)93.1%
【解析】
试题分析:(1)A12O3与纯碱反应的化学方程式为Al2O3+Na2CO3![]() 2NaAlO2+CO2↑;氧化亚铁被氧化为氧化铁,氧化镁没有参与反应,因此滤渣1的主要成分为Fe2O3、MgO。
2NaAlO2+CO2↑;氧化亚铁被氧化为氧化铁,氧化镁没有参与反应,因此滤渣1的主要成分为Fe2O3、MgO。
(2)“③”中通过调节pH除去杂质,根据氢氧化铝的沉淀pH范围可知调节pH至4.7。
(3)“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为H2SO4,这是由于溶液中存在平衡:2CrO42-![]() Cr2O72-+H2O,加入硫酸,平衡向右移动;
Cr2O72-+H2O,加入硫酸,平衡向右移动;
(4).根据Na2Cr2O3.2H2O和Na2SO4的溶解度曲线可知硫酸钠的溶解度随温度的升高而升高,但超过60℃后反而降低,因此提纯的实验操作为:将Na2Cr2O3和Na2SO4的混合溶液蒸发浓缩、趁热过滤,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。
(5).重铬酸根离子氧化碘离子的方程式为实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,反应的离子方程式为14H++Cr2O72-=2Cr3+3I2+7H2O。根据方程式可知Cr2O72-~3I2~6S2O32-,所以所得产品的纯度是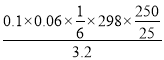 ×100%=93.1%。
×100%=93.1%。

 名校课堂系列答案
名校课堂系列答案