题目内容
【题目】氢氧燃料电池构造如图所示。其电池反应方程式为:2H2+O2=2H2O
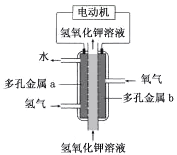
下列说法不正确的是
A. 多孔金属a作负极
B. 多孔金属b上,O2发生还原反应
C. 电池工作时,电解质溶液中OH- 移向a极
D. 正极的电极反应为:O2 +4e- +4H+ =2H2O
【答案】D
【解析】
由电池反应方程式可知,还原剂氢气在负极多孔金属a上放电,电极反应式为H2-2 e- +2OH-=2H2O,氧化剂氧气在正极多孔金属b上放电,电极反应式为O2 +4e- +2H2O =4OH-。
A项、还原剂氢气在负极多孔金属a上放电,故A正确;
B项、氧化剂氧气在正极多孔金属b上放电,发生还原反应,故B正确;
C项、电池工作时,阴离子向负极移动,电解质溶液中OH- 移向a极,故C正确;
D项、氧化剂氧气在正极多孔金属b上放电,电极反应式为O2 +4e- +2H2O =4OH-,故D错误。
故选D。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
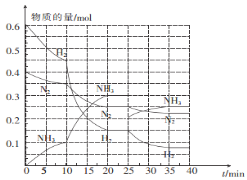
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)