题目内容
【题目】现有短周期主族元素X,Y,Z,R,T;R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( ) 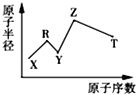
A.原子半径和离子半径均满足:Y<Z
B.最高价氧化物对应的水化物的酸性:T<R
C.气态氢化物的稳定性:Y>T
D.由X,Y,Z,T四种元素组成的化合物水溶液一定呈中性
【答案】C
【解析】解:短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2 , 则Y为O,Z为Na;Z与T形成的Z2T化合物,则T应为S,X的原子半径最小,原子序数最小,则X为H元素.
A.原子半径O>Na,离子半径O2﹣>Na+ , 故A错误;
B.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故B错误;
C.非金属性O>S,故氢化物稳定性:H2O>H2S,故C正确;
D.由H、C、O、Na四种元素组成的化合物不仅仅为NaHCO3 , 可能为有机盐且含有羧基,溶液不一定为碱性,可能为酸性,故D错误.
故选C.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】表中对应关系正确的是( )
A | ① | 均为加成反应 |
B | ①CH3CH3+Cl2 | 均为取代反应 |
C | ① | 均为加聚反应 |
D | ①C(s)+CO2(g)═2CO(g) | 均为△H>0的反应 |
A.A
B.B
C.C
D.D
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等. 
(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2 , Na2O2的电子式为 .
(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是 .
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
质量分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | 5.0 | 60℃ | 0 | 0 | |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | 0 | |
Ⅳ | 4.0% | 5.0 | 常温 | 0 | 1.0 | |
填写表中缺少的内容:Ⅱ;Ⅲ;Ⅳ .
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的极(选填:“正”或“负”);纳米棒向(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O﹣O键和氧气中的O=O键所需的能量依次分别为142kJmol﹣1、497.3kJmol﹣1 . 则反应2H2O2(l)═2H2O(l)+O2(g)△H=kJmol﹣1 .