题目内容
【题目】工业炼铁时有如下副反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)ΔH〉0,该反应能正向自发进行的原因________。某温度时,把Fe和CO2放入体积固定的密闭容器中, CO2的起始浓度为2.0 mol·L-1,达到平衡后, CO的浓度为1.0 mol·L-1,则该温度下上述反应的平衡常数K=_______。再通入一定量的CO,则CO2的物质的量分数将_______。(填增大、减少或不变)若已知该反应的逆反应速率随时间变化的关系如下图,t1-升温,t2-达到平衡,请在图上画出t1-t3时的v逆)的变化曲线______
FeO(s)+CO(g)ΔH〉0,该反应能正向自发进行的原因________。某温度时,把Fe和CO2放入体积固定的密闭容器中, CO2的起始浓度为2.0 mol·L-1,达到平衡后, CO的浓度为1.0 mol·L-1,则该温度下上述反应的平衡常数K=_______。再通入一定量的CO,则CO2的物质的量分数将_______。(填增大、减少或不变)若已知该反应的逆反应速率随时间变化的关系如下图,t1-升温,t2-达到平衡,请在图上画出t1-t3时的v逆)的变化曲线______

【答案】 △S>0,高温条件下自发进行 1.0 不变 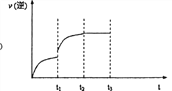
【解析】Fe(s)+CO2(g)![]() FeO(s)+CO(g)ΔH>0,△S>0,根据△G=△H-T△S,高温条件下可以使△G<0,即高温下能自发进行。根据方程式知,平衡时CO的浓度为1.0mol/L,则二氧化碳的浓度也是1.0mol/L,平衡常数K=
FeO(s)+CO(g)ΔH>0,△S>0,根据△G=△H-T△S,高温条件下可以使△G<0,即高温下能自发进行。根据方程式知,平衡时CO的浓度为1.0mol/L,则二氧化碳的浓度也是1.0mol/L,平衡常数K=![]() =
=![]() =1.0;再通入CO,由于压强不影响化学平衡,达到平衡时各组分的含量不变,则CO2的物质的量分数不变;t1时升高温度,正逆反应速率均增大,平衡正向移动,升温后正反应速率大于逆反应速率,t2时达到平衡,逆反应速率图为
=1.0;再通入CO,由于压强不影响化学平衡,达到平衡时各组分的含量不变,则CO2的物质的量分数不变;t1时升高温度,正逆反应速率均增大,平衡正向移动,升温后正反应速率大于逆反应速率,t2时达到平衡,逆反应速率图为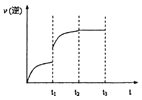 ,故答案为:△S>0,高温条件下自发进行;1.0;不变;
,故答案为:△S>0,高温条件下自发进行;1.0;不变; 。
。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目