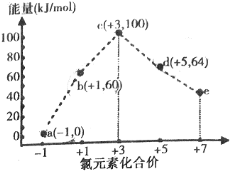
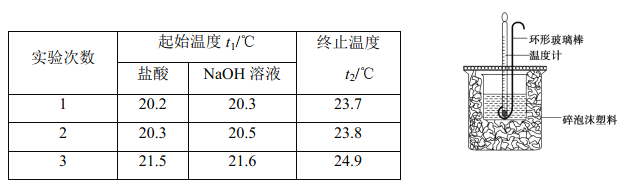
题目内容
【题目】将0.lmol某烃完全燃烧后的产物依次通过盛有浓硫酸和石灰水的广口瓶中浓硫酸的质量增加了 10.8g,盛有石灰水的广口瓶中产生了50g白色沉淀。
(1)通过计算确定该烃的分子式
(2)写出该烃所有可能的结构简式
【答案】(1)C5H12
(2)CH3CH2CH2CH2CH3 CH3CH2CH(CH3)2 C(CH3)4
【解析】本题分析:本题主要考查有关烃燃烧的计算。
(1)浓硫酸吸收10.8g水, 水的物质的量为n=![]() =
=![]() =0.6mol,水中氢为1.2mol,石灰水中产生50g碳酸钙, 碳酸钙的物质的量为n=
=0.6mol,水中氢为1.2mol,石灰水中产生50g碳酸钙, 碳酸钙的物质的量为n=![]() =
=![]() =0.5mol,二氧化碳的物质的量等于碳酸钙的物质的量为0.5mol,烃、C、H的物质的量之比为0.1:0.5:1.2=1:5:12,因此该烃的分子式为C5H12。
=0.5mol,二氧化碳的物质的量等于碳酸钙的物质的量为0.5mol,烃、C、H的物质的量之比为0.1:0.5:1.2=1:5:12,因此该烃的分子式为C5H12。
(2)该烃所有可能的结构简式为CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4。

练习册系列答案
相关题目