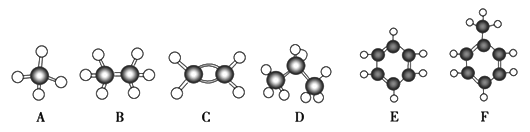
题目内容
【题目】Ⅰ. 实验室用 50 mL 0.50 mol·L-1 盐酸、50 mL 0.55 mol·L-1 NaOH 溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
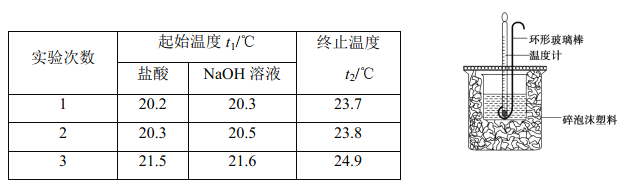
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_____________;不能用铜丝搅拌棒代替环形玻璃棒的理由是____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热 ΔH=___________[盐酸和NaOH溶液的密度按1g·cm-3 计算,反应后混合溶液的比热容(c)按4.18 J·(g· ℃)-1 计算]。
(3)若将 NaOH 溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则 ΔH1 与ΔH的关系为:ΔH1________ΔH( 填 “ < ” 、 “ > ” 或 “ = ”) , 理由是_____________________。
Ⅱ.某学生用 0.1 mol·L-1 的 KOH 标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20 mL 待测盐酸注入洁净的锥形瓶,并加入 2~3 滴酚酞
B.用标准溶液润洗滴定管 2~3 次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准 KOH 溶液注入碱式滴定管至“0”刻度以上 1~2 cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准 KOH 溶液滴定至终点并记下滴定管液面的刻度就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________;
(2)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是__________________;
(3)判断到达滴定终点的实验现象是____________________;
(4)若称取一定量的 KOH 固体(含少量 NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是_______________________。
【答案】Ⅰ(1)上下搅动(或轻轻搅动)(1分)Cu传热快,防止热量损失(1分)
(2)-56.8 kJ·mol-1(2分)
(3)>(1分) NH3·H2O 属于弱电解质,电离吸热(1分)
Ⅱ.(1)B、D、C、E、A、F
(2)使测得的未知溶液浓度偏大
(3)溶液由无色变为浅红色,且在半分钟内不褪色
(4)使测得的未知溶液浓度偏小,原因是同质量的NaOH中和的盐酸比KOH中和的盐酸多(每空2分)
【解析】
试题分析:Ⅰ.(1)实验时用环形玻璃棒搅拌溶液的方法是上下搅动(或轻轻搅动);由于Cu传热快,所以防止热量损失不能用铜丝搅拌棒代替环形玻璃棒。
(2)反应中生成水的物质的量是0.05L×0.5mol/L=0.025mol,放出的热量Q=100g×4.18 J·(g· ℃)-1×3.4 ℃=1421.2J,则该实验测得的中和热 ΔH=-(1.4212kJ÷0.025mol)=-56.8 kJ·mol-1。
(3)一水合氨是弱电解质,存在电离平衡,电离吸热,所以若将 NaOH 溶液改为相同体积、相同浓度的氨水,导致放出的热量减少,则 ΔH1 >ΔH;
Ⅱ.(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为:B、D、C、E、A、F;
(2)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(碱)偏大,根据c(酸)=c(碱)×V(碱)/V(酸),会造成结果偏高;
(3)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色;
(4)如所用KOH含有少量NaOH,则会使结果偏小,因为同质量的NaOH比KOH中和能力强,所需溶液的体积少,所以偏小。

【题目】下列各物质所属类别的判断均正确的一组是( )
混合物 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | 液氨 | 苛性钠 | 胆矾 | 氧化铁 | 二氧化碳 |
B | 纯盐酸 | 烧碱 | 食盐 | 氧化钠 | 二氧化氮 |
C | 8﹒4消毒液 | 纯碱 | 石灰石 | 氨气 | 水 |
D | 聚乙烯塑料 | 熟石灰 | 苏打 | 生石灰 | 二氧化硫 |
A. A B. B C. C D. D