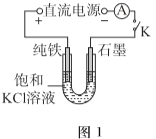
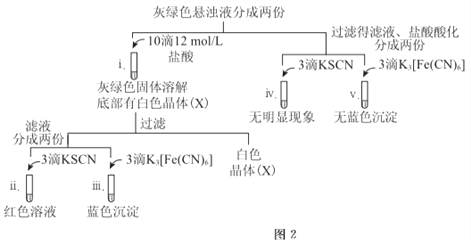
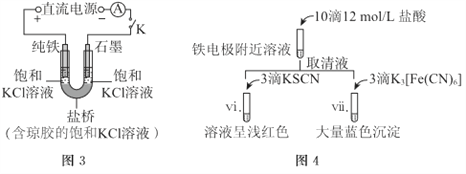
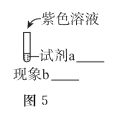
题目内容
【题目】已知: ①亚硝酸钠(NaNO2)是一种食品添加剂,为无色、无气味的同体,具有防腐和抗氧化作用。②AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________。若发生中毒时,你认为下列物质有助于解毒的是____(填字母)。
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_______________。
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________。
(2)在进行滴定操作时,KMnO4溶液盛装在______(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,________时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是________;测得该样品中NaNO2的质量分数为_____。
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果______(填“偏大”、“偏小”或“无影响”,下同);若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。
【答案】 血红蛋白中Fe2+被NO2氧化为Fe3+,导致血红蛋白失去运氧功能 C AgNO3溶液 烧杯、100mL容量瓶 酸式 锥形瓶中无色溶液变成粉红色,且30s内不褪色 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O ![]() 偏大 偏小
偏大 偏小
【解析】I.(1)若发生中毒时,血红蛋白中Fe2+被NO-2氧化为Fe3+,导致血红蛋白失去载氧功能,致使机体组织缺氧;能够解毒的物质即为能够代替![]() 被氧化的物质,题给的牛奶、Mg(OH)2、小苏打都不具有还原性,无法解毒,维生素C具有还原性,可以起到解毒的作用,C正确;正确答案:血红蛋白中Fe2+被NO2氧化为Fe3+,导致血红蛋白失去运氧功能; C 。
被氧化的物质,题给的牛奶、Mg(OH)2、小苏打都不具有还原性,无法解毒,维生素C具有还原性,可以起到解毒的作用,C正确;正确答案:血红蛋白中Fe2+被NO2氧化为Fe3+,导致血红蛋白失去运氧功能; C 。
(2)向由NaCl固体配制的溶液中加入HNO3酸化的AgNO3,生成不溶于HNO3的AgCl沉淀,向 NaNO2固体配制的溶液中加入AgNO3,生成不溶于水的AgNO2浅黄色固体,再加入HNO3后沉淀溶解,可以区分两种固体;正确答案:AgNO3溶液。
II.(1)根据题给仪器外,配制100mL一定物质的量浓度的溶液还需要的玻璃仪器有烧杯、100mL容量瓶;正确答案:烧杯、100mL容量瓶。
(2)酸性 KMnO4溶液具有强氧化性,腐蚀橡胶,因此应该盛装在酸式滴定管中;KMnO4与NaNO2溶液反应,KMnO4被还原为无色的锰离子,当锥形瓶中无色溶液变成粉红色,且30s内不褪色时,说明滴定达到终点;正确答案:烧杯、100mL容量瓶;酸式;锥形瓶中无色溶液变成粉红色,且30s内不褪色 。
(3)KMnO4与NaNO2溶液反应,KMnO4被还原为无色的锰离子,亚硝酸根离子被氧化为硝酸根离子,反应的离子方程式是5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;根据反应关系:5NO2----2MnO4-可知:n(NaNO2)=n(NO2-)=0.0200×VmL×10-3 ×5/2mol;100mL溶液中含有n(NaNO2)= 0.0200×VmL×10-3 ×5/2×100/25 mol, NaNO2的质量为0.0200×VmL×10-3 ×5/2×100/25×69g=1.38V×10-2 g,该样品中NaNO2的质量分数为1.38V×10-2/a×100%=![]() ;正确答案:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
;正确答案:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O; ![]() 。
。
(6)若滴定管未用 KMnO4标准溶液润洗就直接注入,将导致KMnO4的浓度减小,使消耗的 KMnO4标准溶液体积V增大,根据质量分数公式ω(NaNO2)=![]() 可知,测定结果偏大;若测定过程中刚出现颜色变化就停止滴定,NaNO2还未反应完全,使得V减小,根据质量分数公式ω(NaNO2)=
可知,测定结果偏大;若测定过程中刚出现颜色变化就停止滴定,NaNO2还未反应完全,使得V减小,根据质量分数公式ω(NaNO2)=![]() 可知,测定结果偏小;正确答案:偏大; 偏小。
可知,测定结果偏小;正确答案:偏大; 偏小。

 名校课堂系列答案
名校课堂系列答案【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放。某含汞酸性废水(主要含Hg2+、H+、Na+、Cl-等)的处理工艺流程如下图所示:

请回答:
(1)含汞废水未经处理直接排放的危害是_________(填字母)
a.造成水体污染 b. 引起人体中毒
(2)调节pH时加入的溶液A可能是__________(填字母)
a. 盐酸 b. NaOH溶液
(3)图示所用到的废水处理方法为_____________,其中Na2S与Hg2+发生反应的离子方程式为________________________________________。
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl- | SO42- |
浓度(mol/L) | 3.0×10-4 | c | 2.0×10-4 | 2.5×10-4 |
则c(Fe2+) = ______________mol/L。