题目内容
【题目】某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质

(1)一定电压下,按图-1装置电解,现象如下:
石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。按图-2进行实验。

①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。按图-4进行实验

①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质
(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(![]() ),没有沉淀产生。
),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成![]() 的总电极反应式是______。
的总电极反应式是______。
③某同学推测生成![]() 的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
 ______
______
【答案】 2H+ + 2e-= H2↑(或2H2O + 2e- = 2OH- + H2↑) 试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀 试管i中存在溶解平衡:KCl(s) ![]() K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体 阻碍OH-向阳极迁移,避免灰绿色固体生成 本实验条件下铁在阳极区的产物主要为Fe2+ ,Fe2+在碱性条件下更容易被氧化为Fe3+ c(OH-)增大,反应速率加快(更容易放电) Fe -6e- + 8OH- = FeO42- +4H2O 水;生成红褐色沉淀和无色气体
K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体 阻碍OH-向阳极迁移,避免灰绿色固体生成 本实验条件下铁在阳极区的产物主要为Fe2+ ,Fe2+在碱性条件下更容易被氧化为Fe3+ c(OH-)增大,反应速率加快(更容易放电) Fe -6e- + 8OH- = FeO42- +4H2O 水;生成红褐色沉淀和无色气体
【解析】(1)①石墨电极为阴极,溶液中的氢离子放电生成氢气,电极反应式为2H+ + 2e-= H2↑(或2H2O + 2e- = 2OH- + H2↑),故答案为:2H+ + 2e-= H2↑(或2H2O + 2e- = 2OH- + H2↑);
②灰绿色固体用盐酸溶解后的溶液中加入铁氰化钾溶液,生成蓝色沉淀,灰绿色悬浊液过滤后的溶液中加入铁氰化钾溶液,无蓝色沉淀生成,说明灰绿色悬浊液中含有Fe2+,故答案为:试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀;
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色,说明含有钾元素,是因为试管i中存在溶解平衡:KCl(s) ![]() K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体,白色晶体为氯化钾晶体,故答案为:试管i中存在溶解平衡:KCl(s)
K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体,白色晶体为氯化钾晶体,故答案为:试管i中存在溶解平衡:KCl(s) ![]() K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体;
K+ (aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体;
(2)①盐桥中的氯离子代替氢氧根离子向阳极移动,避免灰绿色固体生成,故答案为:阻碍OH-向阳极迁移,避免灰绿色固体生成;
②根据实验I中vi、vii与ii~v中的现象比较可知,①vii中加入铁氰化钾溶液后生成大量蓝色沉淀,说明在使用盐桥的实验条件下铁在阳极区的产物主要为Fe2+ ,vi中溶液在加入KSCN溶液后呈浅红色,说明Fe2+在碱性条件下更容易被氧化为Fe3+,故答案为:本实验条件下铁在阳极区的产物主要为Fe2+ ;Fe2+在碱性条件下更容易被氧化为Fe3+;
(3)①c(OH-)增大,反应速率加快,使得铁电极上OH-能够放电,故答案为:c(OH-)增大,反应速率加快(更容易放电);
②阳极上生成的氧气能够将亚铁离子氧化生成FeO42-,反应的总电极反应式为Fe -6e- + 8OH- = FeO42- +4H2O,故答案为:Fe -6e- + 8OH- = FeO42- +4H2O;
③要推测生成FeO42-的必要条件是浓碱环境,只需要改变溶液的碱性,看是否仍然生成FeO42-即可,实验方案为:将淡紫色(FeO42-)溶液加入水中稀释,使溶液的碱性减弱,4FeO42-+10H2O4Fe(OH)3↓+8OH-+3O2↑,看到生成红褐色沉淀和无色气体,即可说明生成FeO42-的必要条件是浓碱环境,故答案为:水;生成红褐色沉淀和无色气体。

【题目】制备乙炔的电石渣对环境污染极为严重,因此需要对水体进行净化处理。现取500mL电石渣废水(阳离子主要为Ca2+),测定水质的数据如下表所示。

注:SS表示固体悬浮物
模拟工业处理流程如下:

已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是_______。
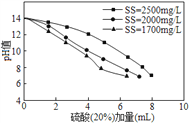
②废水中SS含量随时间变化如下表所示。
静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
为降低成本,减少硫酸投加量的最好办法是_______。
③滤渣A的主要成分有SS和_______。
(2)根据表中数据,回答下列问题。
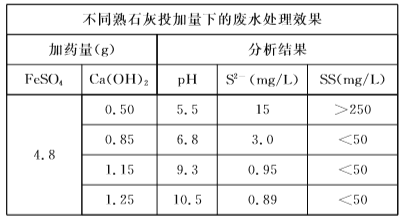
①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是______。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是_______。
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移______mol e-。


