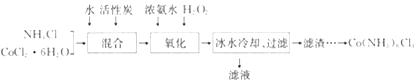
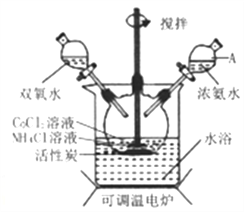
题目内容
【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放。某含汞酸性废水(主要含Hg2+、H+、Na+、Cl-等)的处理工艺流程如下图所示:

请回答:
(1)含汞废水未经处理直接排放的危害是_________(填字母)
a.造成水体污染 b. 引起人体中毒
(2)调节pH时加入的溶液A可能是__________(填字母)
a. 盐酸 b. NaOH溶液
(3)图示所用到的废水处理方法为_____________,其中Na2S与Hg2+发生反应的离子方程式为________________________________________。
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl- | SO42- |
浓度(mol/L) | 3.0×10-4 | c | 2.0×10-4 | 2.5×10-4 |
则c(Fe2+) = ______________mol/L。
【答案】 ab b 沉淀法 S2- + Hg2+ = HgS↓ 2.0×10-4
【解析】(1)汞是重金属,其离子可以使蛋白质变性,所以是有毒离子,含汞的废水未经处理直接排放,会造成水体的污染,同时也可能引起人体中毒。所以选项a、选项b正确。
(2)调节pH的时候应该是将酸性溶液调成碱性,所以只可能是氢氧化钠,选项B正确。
(3)这种将有害离子转化为沉淀除去的方法叫沉淀法。其中Na2S与Hg2+发生反应的离子方程式为:S2- + Hg2+ = HgS↓ 。
(4)根据电荷守恒,得到:3.0×10-4 + 2c = 2×10-4 + 2×2.5×10-4 ,所以c(Fe2+) = 2.0×10-4mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】制备乙炔的电石渣对环境污染极为严重,因此需要对水体进行净化处理。现取500mL电石渣废水(阳离子主要为Ca2+),测定水质的数据如下表所示。

注:SS表示固体悬浮物
模拟工业处理流程如下:
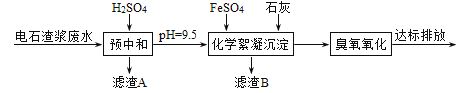
已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是_______。

②废水中SS含量随时间变化如下表所示。
静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
为降低成本,减少硫酸投加量的最好办法是_______。
③滤渣A的主要成分有SS和_______。
(2)根据表中数据,回答下列问题。

①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是______。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是_______。
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移______mol e-。