题目内容
2.25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )| A. | 2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ•mol-1 |
分析 25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则4g氢气燃烧生成液态水,放出571.6kJ热量,热化学方程式应为2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol-1,以此解答该题.
解答 解:4g氢气燃烧生成液态水,放出571.6kJ热量,
A、4g即2mol氢气燃烧生成2mol液态水,放出571.6kJ热量,则2mol液态水分解吸收571.6 kJ的热量,故A正确;
B、B、4g氢气燃烧生成液态水,放出热量571.6kJ,不是气态的水,故B错误;
C、4g氢气燃烧生成液态水,放出热量571.6kJ,不是吸热的,故C错误;
D、4g氢气燃烧生成液态水,放出热量571.6kJ,不是285.8kJ,故D错误;
故选A.
点评 本题主要考查热化学方程式的书写方法及系数的含义,注意焓变的正负和物质的状态.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列分离或提纯物质所用的方法不正确的是( )
| A. | 用蒸馏法从海水中提取淡水 | B. | 用过滤的方法除去粗盐水中的泥沙 | ||
| C. | 用酒精萃取碘水中的碘 | D. | 用NaOH溶液除去铁粉中少量铝粉 |
11.下列离子组一定能大量共存的是( )
| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
12.工业上常利用含硫废水生产海波Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.
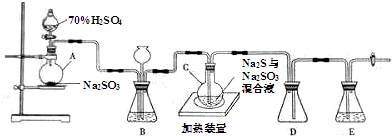
烧瓶C中发生反应如下:
①Na2S+H2O+SO2═Na2SO3+H2S
②2H2S+SO2═3S+2H2O
③S+Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱液面不下降,则整个装置气密性良好.
(2)为提高产品纯度,应使烧瓶C中Na2SO3和Na2S恰好完全反应,则烧瓶C中Na2SO3和Na2S物质的量之比为1﹕2.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.饱和NaOH溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d. 高锰酸钾溶液
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.已知Na2S2O3•5H2O遇酸易分解:S2O${\;}_{3}^{2-}$+2H+═S↓+SO2↑+H2O.利用所给试剂(稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)设计实验,检测产品中是否存在Na2SO4.简要说明实验操作,现象和结论:取样,溶于水配成溶液,加入足量稀盐酸至无气泡产生,在上层清液中滴入BaCl2溶液,若有沉淀生成,则存在Na2SO4.
(5)为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶 液25mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.
测得有关实验数据如下(标准状况):
所用硫酸溶液中溶质的物质的量浓度为4mol/L.(写出计算过程)

烧瓶C中发生反应如下:
①Na2S+H2O+SO2═Na2SO3+H2S
②2H2S+SO2═3S+2H2O
③S+Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱液面不下降,则整个装置气密性良好.
(2)为提高产品纯度,应使烧瓶C中Na2SO3和Na2S恰好完全反应,则烧瓶C中Na2SO3和Na2S物质的量之比为1﹕2.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.饱和NaOH溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d. 高锰酸钾溶液
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.已知Na2S2O3•5H2O遇酸易分解:S2O${\;}_{3}^{2-}$+2H+═S↓+SO2↑+H2O.利用所给试剂(稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)设计实验,检测产品中是否存在Na2SO4.简要说明实验操作,现象和结论:取样,溶于水配成溶液,加入足量稀盐酸至无气泡产生,在上层清液中滴入BaCl2溶液,若有沉淀生成,则存在Na2SO4.
(5)为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶 液25mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |