题目内容
11.下列离子组一定能大量共存的是( )| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
分析 A.常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中存在大量氢氧根离子,铵根离子、铝离子与氢氧根离子反应,铝离子与碳酸根离子发生双水解反应;
B.滴加甲基橙试剂显红色的溶液为酸性溶液,亚铁离子、硝酸根离子在酸性条件下能够发生氧化还原反应;
C.常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应;
D.常温下,$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液为碱性溶液,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液为碱性溶液,溶液中存在大量氢氧根离子,NH4+、Al3+与氢氧根离子反应,Al3+、CO32-之间发生双水解反应,在溶液中一定不能大量共存,故A错误;
B.滴加甲基橙试剂显红色的溶液中存在大量氢离子,在酸性条件下NO3-具有氧化性,能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液为酸性或碱性溶液,CO32-与氢离子反应,在酸性溶液中不能大量共存,故C错误;
D.常温下,$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液中存在大量氢氧根离子,Na+、K+、CO32-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题干暗含条件的含义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的$\frac{11}{12}$(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
| A. | 4:5:2 | B. | 4:6:2 | C. | 6:4:3 | D. | 6:2:3 |
2.25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
| A. | 2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ•mol-1 |
19.在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
| A. | 加入少量0.5mol/L硫酸 | B. | 加入少量1mol/L NaOH溶液 | ||
| C. | 适当加热升高醋酸溶液的温度 | D. | 加入0.1mol/L醋酸溶液100mL |
3.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是( )
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在 | |
| B. | 加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有C1-存在 | |
| C. | 溶液呈黄绿色,且有刺激性气味,说明有C12分子存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在 |
20.使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图:
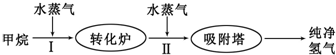
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
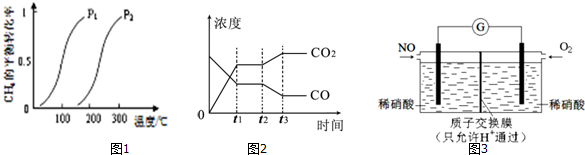
(2)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=0.0225(或2.25×10-2).
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
从上表可以推断:该反应是放热(2分);(2分);反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为75%.图2表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图2中t2时刻发生改变的条件是降低温度.增加水蒸汽的量或减少氢气的量(写出一种).
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
(2)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=0.0225(或2.25×10-2).
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

1.下列溶液中的c (Cl-)与50mL 1mol•L-1氯化铝溶液中的c (Cl-)相等的是( )
| A. | 150mL 1mol•L-1氯化钠溶液 | B. | 159mL 3mol•L-1氯化钾溶液 | ||
| C. | 75mL 1mol•L-1氯化镁溶液 | D. | 75mL 2mol•L-1氯化钙溶液 |