题目内容
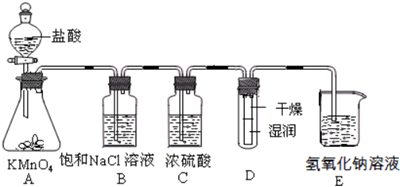
1.某研究性学习小组为了制取、收集纯净干燥的氯气,并探究氯气的性质,他们设计了如图所示的实验装置:
请回答下列问题:
(1)整套实验装置的连接顺序是f接a b接e d接c(填各接口处的字母代号).
(2)E装置中制取氯气的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)B装置的作用是干燥氯气;A装置中试剂X是饱和食盐水.
(4)C装置中可观察到的现象是溶液由无色变蓝色,
(5)漂白粉是常用的消毒剂和漂白剂.根据所学知识,回答下列问题:
①工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
②漂白粉的有效成分是(化学式)Ca(ClO)2.
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的化学反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
分析 (1)依据实验目的可知装置连接顺序为:发生装置、净化装置、收集装置、性质检验装置、尾气吸收装置排序;
(2)实验室用加热二氧化锰与浓盐酸制备氯气;
(3)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,所以制取的氯气中含有氯化氢和水蒸气,依据二者性质选择除杂试剂;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝;
(5)①氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
②漂白粉的有效成分是次氯酸钙;
③漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸;
解答 解:(1)为制取、收集纯净干燥的氯气,并探究氯气的性质,则装置连接为:发生装置、净化装置、收集装置、性质检验装置、尾气吸收装置,A、B为净化装置,C为性质检验装置,D为尾气吸收装置,E为发生装置,F为收集装置,所以正确的顺序为:fabedc;
故答案为:abedc;
(2)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,要制取纯净干燥的氯气应依次除去氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以选择饱和食盐水除去氯气,浓硫酸具有吸水性,能够干燥氯气,
故答案为:干燥氯气;饱和食盐水;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝,所以C中现在为:溶液由无色变蓝色;
故答案为:溶液由无色变蓝色;
(5)①氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②漂白粉的有效成分是次氯酸钙,化学式为:Ca(ClO)2;
故答案为:Ca(ClO)2;
③漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质为次氯酸,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
点评 本题考查了氯气的制备及其性质应用,主要考查化学方程式的书写,明确氯气制备原理和性质是解题关键,题目难度不大.

 A、B、C三种强电解质,它们在水中电离出的离子如表所示:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
(1)M为电源的负极(填“正”或“负”),e电极上产生的气体体积为2.8L(标准状况下).
(2)e电极上发生的电极反应为2H++2e-=H2↑.
| A. | 铜与硝酸银溶液反应 Cu+Ag+═Cu2++Ag | |
| B. | CH3COOH溶液与NaOH溶液反应 H++OH-═H2O | |
| C. | 碳酸镁与稀H2SO4反应 MgCO3+2H+═Mg2++H2O+CO2↑ | |
| D. | 石灰乳与稀盐酸反应 H++OH-═H2O |
| A. | 0.01mol | B. | 0.1mol | C. | 0.02mol | D. | 0.2mol |
| A. | 烧菜用过的铁锅,经放置因发生氧化还原反应常出现红棕色斑迹 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量的MgSO4 | |
| C. | 蒸馏时温度计时用来测定蒸馏烧瓶中液体的温度 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
 .
.