题目内容
6.下列说法错误的是( )| A. | 常温常压下,等质量的CO2和环氧乙烷中的共用电子对数之比为4:7 | |
| B. | 标准状况下,1mol N2O4的体积大于22.4L是因为存在NO2和N2O4之间的转化 | |
| C. | 已知NaBH4+2H2O=NaBO2+4H2↑,则每摩尔氧化剂参加反应,转移电子的物质的量为2mol | |
| D. | 溶质为1molFeCl3的溶液中生成的氢氧化铁胶粒不可能为1NA |
分析 A.CO2的结构为O=C=O,环氧乙烷的结构简式为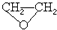 ;
;
B.N2O4的沸点为21.2℃,标准状况下,N2O4为液体;
C.反应中得电子的物质为氧化剂,结合化合价的变化判断;
D.氢氧化铁胶粒是大量Fe(OH)3 集合体.
解答 解:A.CO2和环氧乙烷的摩尔质量相同,等质量的CO2和环氧乙烷的物质的量相同,CO2的结构为O=C=O含有4个共用电子对,环氧乙烷的结构简式为 含有7个共用电子对,则共用电子对数之比为4:7,故A正确;
含有7个共用电子对,则共用电子对数之比为4:7,故A正确;
B.N2O4的沸点为21.2℃,标准状况下,N2O4为液体,1mol N2O4的体积小于22.4L,故B错误;
C.已知NaBH4+2H2O=NaBO2+4H2↑,氧化剂为H2O,1molH2O参加反应,转移电子的物质的量为2mol,故C正确;
D.氢氧化铁胶粒是大量Fe(OH)3 集合体,溶质为1molFeCl3的溶液中生成的氢氧化铁胶粒小于1NA,故D正确.
故选B.
点评 本题考查了有机物的结构、物质的量的计算、氧化还原反应等,题目难度不大,侧重于考查学生对基础知识的综合应用能力,注意把握共用电子对的计算方法.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
11.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O═2Zn(OH)42-.下列说法正确的是( )
| A. | 锌极发生还原反应 | |
| B. | 电子从锌极经KOH溶液移向充空气的电极 | |
| C. | 锌极会损耗,需更换 | |
| D. | 此装置是电能转化为化学能的装置 |
17.一定量的Fe、FeO、Fe 2O 3、Fe 3O 4的混合物中加入350mL 2molL -1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H 2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
| A. | 0.1mol | B. | 0.225mol | C. | 0.3mol | D. | 0.25mol |
14.下列物质中,不属于醇的是( )
| A. |  | B. |  | ||
| C. |  | D. | CH3OH |
1.某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
下列分析不正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 物质 | CaCO3(固体) | H2O | CaCO3饱和溶液 | CaSO4饱和溶液 | NaCl0.001mol/L | AgNO30.001mol/L | AgCl饱和溶液 |
| 电导率 | 0 | 7 | 37 | 389 | 1989 | 1138 | 13 |
| A. | CaCO3固体中不存在自由移动的离子 | |
| B. | 与②对比,说明⑦中存在:AgCl=Ag++Cl- | |
| C. | ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13 | |
| D. | 将①中固体加入④中,发生反应:CaCO3(s)+SO42-(aq)=CaSO4(s)+CO32-(aq) |
11.下列物质中含有离子键且阴离子与阳离子数目比为1:2的是( )
| A. | CaO | B. | Na2O2 | C. | KF | D. | NaHCO3 |
5. 如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间的变化情况,试根据图中曲线判断下列说法中不正确的是( )
如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间的变化情况,试根据图中曲线判断下列说法中不正确的是( )
 如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间的变化情况,试根据图中曲线判断下列说法中不正确的是( )
如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间的变化情况,试根据图中曲线判断下列说法中不正确的是( )| A. | t3时刻可能采取的措施是减小D的浓度 | |
| B. | t5时刻可能采取的措施是降温 | |
| C. | t7时刻可能采取的措施是减小压强 | |
| D. | t5~t6时间段平衡向逆反应方向移动 |
3.下列关于CH4和CO2的说法正确的是( )
| A. | SiO2属于分子晶体 | |
| B. | CH4分子中含有极性共价键,是极性分子 | |
| C. | 因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2 | |
| D. | CH4和CO2分子中碳原子的杂化类型分别是sp3和sp |



