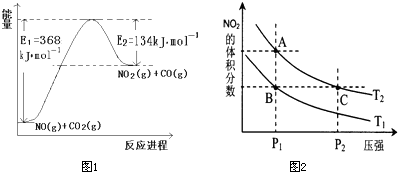
题目内容
下表是固定容积容器中反应 2A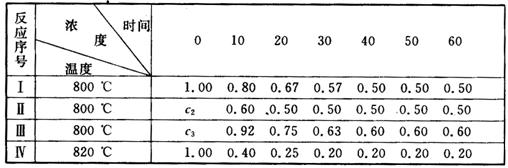
A.实验Ⅰ中20至30分钟内平均反应速率为vA=0.01 mol(L·min)
B.若实验Ⅱ中A的初始浓度c2为1.00 mol/L,则反应经20分钟达平衡且使用了催化剂
C.若实验Ⅱ中c2为1.00 mol/L,则实验Ⅲ中A的初始浓度c3肯定大于c2
D.由实验Ⅳ和实验I的数据比较,可推知该反应的正反应是放热反应
D
【解析】从题目数据来看,反应I在40分钟后达到平衡,反应Ⅱ在20分钟后达到平衡,反应Ⅲ在40分钟后达到平衡,反应Ⅳ在30分钟后达到平衡。根据题意,该反应的体积不变,条件由I变化到Ⅱ,温度不变则A的平衡浓度不变,若c2=1.00,则平衡没有移动,应该是使用了催化剂;条件Ⅲ中温度仍然没有变化,B、C的起始浓度没有变化,但A的平衡浓度增大,若此情况下其他条件没有发生改变则平衡不可能向逆方向移动,因此只可能为反应物浓度增大,即c3>c2;条件Ⅳ温度升高,A的平衡浓度减小,说明平衡向正方向移动,因此正反应吸热。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目