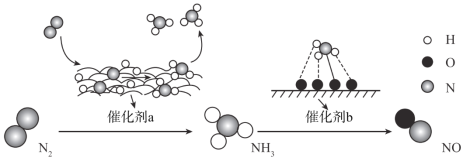
题目内容
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
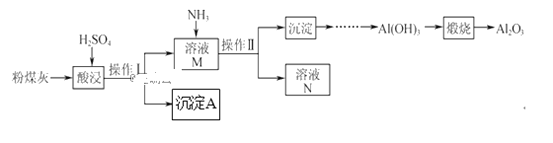
(1)操作Ⅰ的名称是__。
(2)用H2SO4“酸浸”时的离子方程式为__(任写一个)。
(3)简述如何检验酸浸后溶液中是否有Fe3+__。
(4)“煅烧”时的化学方程式为__。
(5)沉淀A与氢氟酸反应的化学方程式为__。
【答案】过滤 Fe2O3+6H+=2Fe3++3H2O(或Al2O3+6H+=Al3++3H2O任写一个) 取适量该溶液于试管中,加入KSCN,若变红则有Fe3+ 2Al(OH)3![]() Al2O3+3H2O SiO2+4HF=SiF4↑+2H2O
Al2O3+3H2O SiO2+4HF=SiF4↑+2H2O
【解析】
粉煤灰(主要含Al2O3、SiO2, 还有少量的Fe2O3)和稀硫酸混合,发生反应Al2O3+3H2SO4═Al2(SO4)3+3H2O,Fe2O3+3H2SO4═Fe 2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤溶液得滤渣Ⅰ为SiO2; 根据Fe3+遇KSCN溶液变红色检验溶液中是否有Fe3+;Al(OH)3加热分解为Al2O3和水;SiO2与氢氟酸反应生成SiF4和水。
(1)操作Ⅰ实现了固体SiO2和溶液的分离,操作Ⅰ的名称是过滤。
(2)用H2SO4“酸浸”时Al2O3、Fe2O3与硫酸反应,反应的离子方程式分别为Al2O3+6H+=Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)Fe3+遇KSCN溶液变红色,检验溶液中是否有Fe3+的方法是:取适量该溶液于试管中,加入KSCN,若变红则有Fe3+。
(4)“煅烧”时Al(OH)3分解为Al2O3和水,化学方程式为2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。
(5)沉淀A是SiO2,SiO2与氢氟酸反应生成SiF4和水,化学方程式为SiO2+4HF=SiF4↑+2H2O。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示:
气体读数/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
B瓶(盐酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列说法不正确的是( )
A.0~5mL时,A与B反应速率不同的原因是c(H+)不同所致
B.5~10mL时,A瓶平均反应速率为![]() mL·s1
mL·s1
C.0~20mL时,A瓶反应速率增大,可能是温度升高所致
D.0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率