题目内容
【题目】在不同温度下,水溶液中-lg c(H+)与-lg c(OH)。关系如图所示。下列说法不正确的是( )
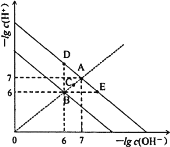
A.图中五点Kw间的关系:B>C>A=D=E
B.A→E点对应的水溶液中,可能有NH4+、Ba2+、Cl、I大量同时存在
C.若0.1mol·L1的NaHA溶液水溶液中c(H+)与c(OH)关系如图D点所示,则溶液中有:c(HA)>c(OH)>c(A2)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH)关系如图E点所示,则溶液中反应:2H++SO42-+Ba2++2OH=BaSO4↓+2H2O
【答案】C
【解析】
A. 同一条曲线上的点Kw相同,所以A=D=E,离原点越近,氢离子浓度、氢氧根离子的浓度越大,Kw越大,所以图中五点Kw间的关系:B>C>A=D=E,故A正确;
B. A→E点对应的水溶液中,氢离子浓度大于氢氧根离子,溶液呈酸性,可能有NH4+、Ba2+、Cl、I大量同时存在,故B正确;
C. D点所示溶液呈碱性,则0.1mol·L1的NaHA溶液水溶液呈碱性,说明HA水解大于电离,则溶液中有:c(HA)>c(OH)>c(H2A) >c(A2),故C错误;
D. E点所示的溶液呈酸性,说明NaHSO4与Ba(OH)2的比大于2:1,Ba(OH)2溶液中钡离子、氢氧根离子能完全反应,则溶液中反应:2H++SO42-+Ba2++2OH=BaSO4↓+2H2O,故D正确。
选C。

练习册系列答案
相关题目