题目内容
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2C1的电子式______________________。
(2)写出NH2C1与水反应的化学方程式______________________。
(3)一定条件下(T℃、1.01×105Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:

写出该反应的热化学方程式____________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
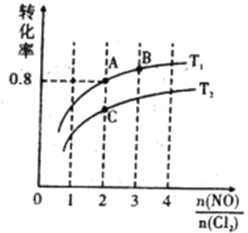
(4)图中T1、T2的关系为:T1______T2 (填“>”、“<”或“=”)
(5)图中纵坐标为物质__________的转化率,理由为___________________________。
(6)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”、“B”、或“C”)。
(7)若容器容积为1L,则B点的平衡常数为____________。
【答案】 ![]()
![]()
![]() < Cl2
< Cl2 ![]() 增加时Cl2的转化率增大(或其他合理表述均给分) A 80L/mol
增加时Cl2的转化率增大(或其他合理表述均给分) A 80L/mol
【解析】(1)NH2C1的电子式为![]() ;(2)NH2C1与水反应生成次氯酸和氨气,反应的化学方程式为
;(2)NH2C1与水反应生成次氯酸和氨气,反应的化学方程式为![]() ;(3)反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)的
;(3)反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)的![]() H=(+243.0+391.3
H=(+243.0+391.3![]() )kJ/mol= +11.3kJ/mol;(4)反应2NO(g)+Cl2(g)
)kJ/mol= +11.3kJ/mol;(4)反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0是放热反应,升高温度平衡逆向移动,转化率减小,故T1<T2;(5)随着氮氯比
2NOCl(g) △H<0是放热反应,升高温度平衡逆向移动,转化率减小,故T1<T2;(5)随着氮氯比![]() 增大,转化率增大,故图中纵坐标为物质Cl2的转化率,理由为
增大,转化率增大,故图中纵坐标为物质Cl2的转化率,理由为![]() 增加时Cl2的转化率增大;(6)升高温度平衡逆向移动,NOCl的体积分数减小,故A点NOCl体积分数比B点大;氮氯比
增加时Cl2的转化率增大;(6)升高温度平衡逆向移动,NOCl的体积分数减小,故A点NOCl体积分数比B点大;氮氯比![]() 越大,NO的转化率越小,NOCl的体积分数越小,故图中A、B、C三点对应的NOCl体积分数最大的是A点;(7)温度相同,化学平衡常数相同,则A点与B点平衡常数相同,A点氯气的转化率为0.8,
越大,NO的转化率越小,NOCl的体积分数越小,故图中A、B、C三点对应的NOCl体积分数最大的是A点;(7)温度相同,化学平衡常数相同,则A点与B点平衡常数相同,A点氯气的转化率为0.8,![]() =2,即NO和氯气的物质的量分别为2mol/L、1mol/L,则
=2,即NO和氯气的物质的量分别为2mol/L、1mol/L,则
2NO(g) + Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
开始时浓度(mol/L) 2 1 0
改变的浓度(mol/L) 1.6 0.8 1.6
平衡时浓度(mol/L) 0.4 0.2 1.6
![]() =80 L/mol。
=80 L/mol。