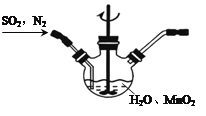
题目内容
【题目】有关物质的转化关系如图所示(部分反应的产物已略去)。A只含两种元素,摩尔质量为72g·mol1。B是无色气体,其水溶液是常见的酸,C是常见金属,E的组成元素与水相同,其水溶液常用于实验室制氧气,H的俗名是熟石灰,J为红褐色固体。

(1)A的化学式为___。
(2)D的电子式为___。
(3)写出反应③的离子方程式:___。
(4)写出反应④的化学方程式:___。
【答案】CaO2 ![]() H2O2+2H++2Fe2+=2Fe3++2H2O 3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
H2O2+2H++2Fe2+=2Fe3++2H2O 3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
【解析】
H的俗名是熟石灰,H是Ca(OH)2;E的组成元素与水相同,其水溶液常用于实验室制氧气,E是H2O2;A只含两种元素,与B反应生成E(H2O2),A为CaO2,CaO2与酸反应生成过氧化氢,B是无色气体,其水溶液是常见的酸,则B为HCl;J为红褐色固体,J应该是Fe(OH)3;则金属C应该是Fe,以此解答对应物质的性质以及题目要求解答该题。
(1)由分析可知,A为CaO2,化学式为:CaO2;
(2)A为CaO2,B为HCl,CaO2+2HCl=CaCl2+H2O2,则D为CaCl2,电子式为![]() ;
;
(3)E是H2O2,B为HCl,C是Fe,则Fe我FeCl2,反应③的离子方程式为:H2O2+2H++2Fe2+=2Fe3++2H2O;
(4)由三可知I为FeCl3,J为红褐色固体,J应该是Fe(OH)3, H为Ca(OH)2,④的化学方程式为:3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.R原子的核外电子排布图为![]()
B.Y2-与Na+的半径大小关系为Y2->Na+
C.X的第一电离能小于Y的第一电离能
D.表中电负性最大的元素为W
【题目】I. 现有一组物质的熔点(℃)数据,据此回答下列问题:
HF:-83 | HCl:-115 | HBr:-89 | HI:-51 |
(1)HF熔点反常是由于______________。这组物质中共价键的键能最大的是_____。
II.按要求回答下列问题。
(2)CS2气化时克服的粒子间作用是__________,1mol CS2中含有___mol σ键,含有___mol π键。
(3)HCHO分子中C原子轨道的杂化类型为______。