题目内容
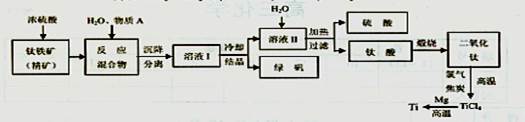
(15分)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由 ;
(3)上述生产流程中加人物质A的目的是防止Fe2+被氧化,物质A是____,上述制
备TiO2的过程中,所得到的副产物及可回收利用的物质是 。
(4)钛、氯气和过量焦炭在高温下反应的化学方程式 ;
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数____(用A、B字母表示)。

回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由 ;
(3)上述生产流程中加人物质A的目的是防止Fe2+被氧化,物质A是____,上述制
备TiO2的过程中,所得到的副产物及可回收利用的物质是 。
(4)钛、氯气和过量焦炭在高温下反应的化学方程式 ;
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数____(用A、B字母表示)。

(1)由反应式知该反应为非氧化还原反应;(2)Ti、Mg在高温下易于氧气、氮气等
物质反应,所以TiCl4+2Mg=2MgCl2+Ti应在Ar气氛中进行;(3)防止Fe2+被氧化,可加
Fe;由流程知得到的副产物及可回收利用的物质有绿矾、硫酸、铁、一氧化碳等;(4)
TiO2+2Cl2+2C=TiCl4+2CO ;(5)不考虑损耗,根据质量守恒定律知钛铁矿中含钛Bt,即
钛铁矿中钛的质量分数为B/A。
物质反应,所以TiCl4+2Mg=2MgCl2+Ti应在Ar气氛中进行;(3)防止Fe2+被氧化,可加
Fe;由流程知得到的副产物及可回收利用的物质有绿矾、硫酸、铁、一氧化碳等;(4)
TiO2+2Cl2+2C=TiCl4+2CO ;(5)不考虑损耗,根据质量守恒定律知钛铁矿中含钛Bt,即
钛铁矿中钛的质量分数为B/A。

练习册系列答案
相关题目
 CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。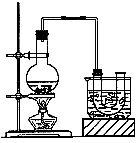
 证气体性质的装置图
证气体性质的装置图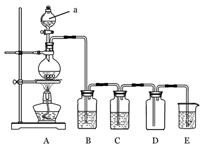
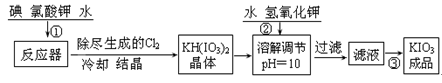
 偏高”“偏低”或“无影响”)。
偏高”“偏低”或“无影响”)。