题目内容
(13分)Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液进行实验,改变条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
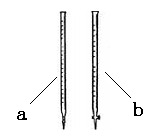
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质 |
| ① | 2 mL | 20 | |
| ② | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 mL | 30 | |
| ④ | 1 mL | 20 | 1 mL蒸馏水 |
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。

(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
Ⅰ.(1)①和② (1分) ; ①和③ (1分)
(2)硫酸的浓度或氢离子浓度(2分); 确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变 (2分)
Ⅱ.(1)否 ,KMnO4溶液呈紫色,达滴定终点紫色不再褪去。(2分)
(2)b (2分) (3)75% (3分)
(2)硫酸的浓度或氢离子浓度(2分); 确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变 (2分)
Ⅱ.(1)否 ,KMnO4溶液呈紫色,达滴定终点紫色不再褪去。(2分)
(2)b (2分) (3)75% (3分)
Ⅰ.(1)要研究催化剂对化学反应速率的影响,则其它条件应该是相同的,所以应该用实验①和②。同样要研究温度对化学反应速率的影响,其它条件也应该是相同的,所以应该用实验①和③。
(2)对比实验①和④可知硫酸的浓度是不同的,所以可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响。由于实验①中硫酸的体积是2ml,所以为确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变,需要加入1ml水。
Ⅱ.(1)由于酸性KMnO4溶液呈紫色,达滴定终点紫色不再褪去,所以不需要另加指示剂。
(2)酸性高锰酸钾溶液具有强氧化性,能腐蚀橡胶,所以应该用酸式滴定管。
(3)15.00 mL高锰酸钾的物质的量是0.2000mol/L×0.015L=0.003mol,得到电子是0.003mol×5=0.015mol,所以根据电子得失守恒可知,草酸钠的物质的量是0.015mol÷2=0.0075mol,质量是0.0075mol×134g/mol=1.005g,因此质量分数为1.005g÷1.34g×100%=75%。
(2)对比实验①和④可知硫酸的浓度是不同的,所以可以研究硫酸的浓度或氢离子浓度对化学反应速率的影响。由于实验①中硫酸的体积是2ml,所以为确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变,需要加入1ml水。
Ⅱ.(1)由于酸性KMnO4溶液呈紫色,达滴定终点紫色不再褪去,所以不需要另加指示剂。
(2)酸性高锰酸钾溶液具有强氧化性,能腐蚀橡胶,所以应该用酸式滴定管。
(3)15.00 mL高锰酸钾的物质的量是0.2000mol/L×0.015L=0.003mol,得到电子是0.003mol×5=0.015mol,所以根据电子得失守恒可知,草酸钠的物质的量是0.015mol÷2=0.0075mol,质量是0.0075mol×134g/mol=1.005g,因此质量分数为1.005g÷1.34g×100%=75%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

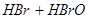 ,当加入
,当加入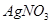 溶液后,溶液颜色变浅
溶液后,溶液颜色变浅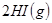
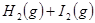 平衡体系,增大平衡体系的压强可使颜色变深
平衡体系,增大平衡体系的压强可使颜色变深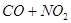
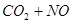 (正反应放热),升高温度可使平衡向逆反应方向移动
(正反应放热),升高温度可使平衡向逆反应方向移动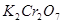 的溶液中存在着如下平衡:
的溶液中存在着如下平衡: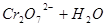
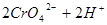
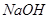
 2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是