题目内容
【物质结构与性质】
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2 np2,B元素原子的最外层鬼子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(1)当n=2时,AB2属于 分子(填“极性”或“非极性”),分子中有 个δ键、 个π键. A6H6分子中A原子的杂化轨道类型是 杂化.
(2)当n=3时,A与B形成的晶体属于 晶体.
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是 (用元素符号表示);A、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O.该配合物中的中心离子钴离子
在基态时的核外电子排布式为 .作为配位体之一的NH3分子的空间构型为
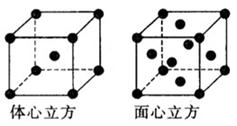
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为
(1)非极性2 2 sp2(4分,每空1分)
(2)原子(1分)
(3)S >P >Si(2分)P>S>Si(2分)
(4) CO3+:1s22s22p63s23p63d6或[Ar]3d6(2分) 三角锥形(或四面体形)(2分)
(5)1:2(2分)

练习册系列答案
相关题目


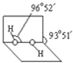 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取