题目内容
【题目】下表是A、B、C、D、E五种有机物的有关信息:
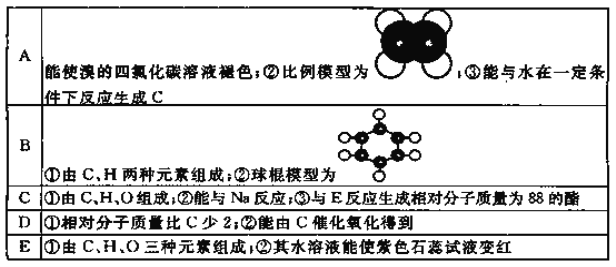
回答下列问题:
(1) A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)有机物B具有的性质是_______________________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:____________________(用化学方程式说明)。
【答案】
(1AB
(2)CH2=CH2+Br2→CH2BrCH2Br
(3)②③
(4)CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑
【解析】
试题分析:A能使溴水褪色说明含有碳碳双键或三键,结合其比例模型,可知A为CH2=CH2;A能和水反应生成C,C由C、H、O三种元素组成,能与Na反应,则C为CH3CH2OH;E的水溶液能使紫色石蕊试液变红,说明E为羧酸,乙醇与E反应生成相对分子质量为88的酯,则E为CH3COOH;根据B的组成元素及其球棍模型知,B是![]() ;D的相对分子质量比C少2,且能由C催化氧化得到,所以D是CH3CHO。
;D的相对分子质量比C少2,且能由C催化氧化得到,所以D是CH3CHO。
(1)A~E中,属于烃的是乙烯、苯。
故答案为:AB;
(2)CH2=CH2能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br。
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(3)苯是无色有特殊气味的、不溶于水且密度小于水的有毒液体,和酸性KMnO4溶液和溴水都不反应。
故选:②③;
(4)根据强酸制取弱酸的原理证明醋酸的酸性大于碳酸,醋酸和NaHCO3反应生成二氧化碳气体就能
证明醋酸的酸性大于碳酸,反应方程式为:CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑。
故答案为:CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑。

 快捷英语周周练系列答案
快捷英语周周练系列答案