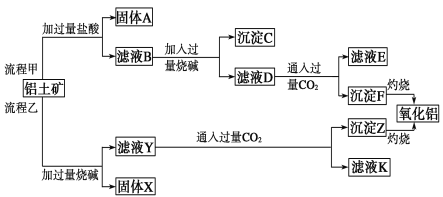
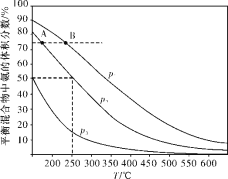
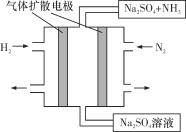
题目内容
【题目】微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。如图是一种微生物燃料电池的工作原理示意图,下列有关说法不正确的是
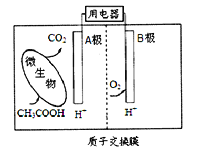
A. B电极是正极
B. 电池内H+从左侧向右侧迁移
C. A电极的电极反应式: CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. 该电池可利用有机废水等有机废弃物作为燃料
【答案】C
【解析】CH3COOH中C元素平均价态为0,转变为CO2,化合价升高,故CH3COOH失电子,A为负极, B为正极,故A正确;B、电池中阳离子向正极移动,故B正确;C、A电极为负极,失电子,电极反应应为CH3COOH8e+2H2O═2CO2↑+8H+,故C错误;该电池可将废水中的有机物作为燃料,制成燃料电池,D正确。故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目