题目内容
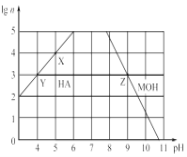
【题目】已知pC=-lgc(B),室温下,某二元酸(H2A)中部分微粒的pC值随溶液pH值变化关系如图所示。下列说法错误的是( )

A.曲线a表示的微粒是H+
B.溶液中水的电离程度:m>n
C.pH=8时,溶液中,c(HA-)>c(H2A)
D.pH=1与pH=3时,H2A的浓度几乎相同
【答案】B
【解析】
pC=-lgc(B),pH=-lgc(H+),所以氢离子的pC值等于溶液的pH,即曲线a表示的微粒是氢离子,pH增大的过程中发生反应:![]() 、
、![]() ;浓度最先减小的是H2A,即曲线b代表的微粒是H2A,HA-先增大后减小,所以曲线c代表的是HA-,曲线d代表的是A2-,则曲线e代表的是OH-,据此进行分析。
;浓度最先减小的是H2A,即曲线b代表的微粒是H2A,HA-先增大后减小,所以曲线c代表的是HA-,曲线d代表的是A2-,则曲线e代表的是OH-,据此进行分析。
A. pC=-lgc(B),pH=-lgc(H+),所以氢离子的pC值等于溶液的pH,即曲线a表示的微粒是氢离子,故A正确;
B.据图可知,m点处溶液中主要存在H2A的电离,c(H+)=10-4mol/L,水的电离出的c(OH-)=10-10mol/L;n点处c(HA-)还会随pH升高而下降,即继续加碱,碱电离出的氢氧根会被反应,所以n点显碱性主要是由于HA-和A2-的水解,溶液pH=10,c(OH-)=10-4mol/L,且氢氧根为水电离出来的氢氧根,所以水的电离程度:n>m,故B错误;
C. 曲线b代表的微粒是H2A,曲线c代表的是HA-,根据图可知pH=8时,溶液中,c(HA-)>c(H2A),故C正确;
D. 曲线b代表的微粒是H2A,pH=1到pH=3,H2A的浓度变化不大,故D正确;
故答案为B。

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目